Производство дрожжей: Технология производства хлебопекарных дрожжей.
Технологическая линия производства хлебопекарных дрожжей
Характеристика продукции, сырья и полуфабрикатов. Дрожжи — одноклеточные микроорганизмы, относящиеся к классу грибов сахаромицетов. Дрожжевая клетка содержит в среднем 67 % воды и 33 % сухого вещества. Сухое вещество дрожжевой клетки содержит 37…50 % белков, 35…40 % углеводов, 1,2…2,5 % сырого жира и 6… 10 % зольных веществ.
Качество хлебопекарных дрожжей определяется требованиями технологии хлеба. Они должны иметь плотную консистенцию, легко ломаться, обладать серым с желтоватым оттенком цветом и характерным дрожжевым запахом, пресным вкусом, содержание влаги не более 75 %, кислотность (в пересчете на уксусную кислоту) не более 120 мг на 100 г дрожжей в день выработки и не более 360 мг спустя 12 сут. Стойкость при температуре 35 °С дрожжей, выработанных на дрожжевых заводах, не менее 60 ч, а на спиртовых 48 ч, подъемная сила (подъем теста до 70 мм) не более 70 мин.
Предусматривается выпуск сушеных хлебопекарных дрожжей высшего и 1 сортов в виде гранул, вермишели, крупы или порошка от светло-желтого до светло-коричневого цвета. Содержание влаги в дрожжах высшего сорта — 8 %, в дрожжах 1 сорта — 10 %. Подъем теста до 70 мм для высшего сорта — 70 мин, для 1 сорта — 90 мин. Сохранность со дня выработки составляет для сушеных дрожжей не менее 12 мес для высшего сорта и 5 мес для 1 сорта.
Показатели качества дрожжей, дрожжевого молока (водной суспензии): концентрация дрожжей не менее 450 г/л в пересчете на влажность 75 %, подъемная сила не более 75 мин, кислотность не более 120 мг на 100 г дрожжей в день выработки и не более 360 мг через 72 ч.
Особенности производства и потребления готовой продукции. Дрожжевое производство основано на способности дрожжевых клеток (микроорганизмов) расти и размножаться. В основе технологии хлебопекарных дрожжей на дрожжевых заводах лежат биохимические процессы, связанные с превращением питательных веществ культуральной среды при активной аэрации в клеточное вещество дрожжей. При аэрации дрожжи окисляют сахар питательной среды до воды и диоксида углерода (аэробное дыхание). Выделившаяся при этом тепловая энергия используется дрожжами для синтеза клеточного вещества и обменных процессов. В аэробных условиях в субстрате накапливаются значительно большие биомассы, чем при анаэробном дыхании.
При аэрации дрожжи окисляют сахар питательной среды до воды и диоксида углерода (аэробное дыхание). Выделившаяся при этом тепловая энергия используется дрожжами для синтеза клеточного вещества и обменных процессов. В аэробных условиях в субстрате накапливаются значительно большие биомассы, чем при анаэробном дыхании.
Состав и концентрация питательной среды для культивирования дрожжей обуславливает скорость их размножения и конечный выход продуктов. Для конструктивного и энергетического обмена дрожжей используют сахара, азотистые соединения, зольные элементы и кислород воздуха.
Хлебопекарные дрожжи культивируют на мелассных средах, разбавленных водой. Сахар такой среды легко усваивается дрожжами. Теоретический выход биомассы дрожжей с 75%-ным влагосодержанием находится в пределах 97… 117 % по отношению к массе мелассы, содержащей 46 % сахара. В заводских условиях выход дрожжей составляет лишь 68…92 %.
Дрожжи используют в хлебопечении в качестве возбудителя спиртового брожения и разрыхлителей теста. Их применяют также для получения кваса, витаминов, лекарственных препаратов и питательных сред. На дрожжевых заводах вырабатывают прессованные и сушеные дрожжи, а также дрожжевое молоко. На мелассно-спиртовых заводах получают только прессованные дрожжи. Жидкие дрожжи и хлебные закваски готовят непосредственно на хлебозаводах.
Их применяют также для получения кваса, витаминов, лекарственных препаратов и питательных сред. На дрожжевых заводах вырабатывают прессованные и сушеные дрожжи, а также дрожжевое молоко. На мелассно-спиртовых заводах получают только прессованные дрожжи. Жидкие дрожжи и хлебные закваски готовят непосредственно на хлебозаводах.
На мелассно-спиртовых заводах вырабатывают 15 % хлебопекарных дрожжей от общего их выпуска. Эти дрожжи получают в качестве отходов производства при сепарации зрелой спиртовой бражки, в 1 м
Стадии технологического процесса. Процесс получения хлебопекарных дрожжей на дрожжевых заводах складывается из следующих стадий:
— приготовление питательной среды;
— выращивание маточных и товарных дрожжей;
— выделение товарных дрожжей из дрожжевой суспензии;
— формование и упаковка прессованных дрожжей;
— сушка дрожжей.
Получение дрожжей из спиртовой бражки на спиртовых заводах состоит из стадий:
— выделение дрожжей из зрелой бражки сепарированием;
— промывание и концентрирование дрожжевой суспензии;
— дозревание дрожжей;
— окончательное промывание и концентрирование дрожжей;
— прессование, формование и упаковка дрожжей;
— хранение.
Характеристика комплексов оборудования. Линия начинается с комплекса оборудования для обработки сырья, состоящего из аппаратов для приготовления питательных сред, сепараторов-кларификаторов для мелассы и пароконтактных установок для стерилизации.
Ведущий комплекс линии представляют дрожжерастильные аппараты, снабженные аэрационной системой для насыщения суспензии кислородом, и воздуходувные машины.
Следующий комплекс линии состоит из аппаратов для выделения дрожжей, в составе которого имеются дрожжевые сепараторы, фильтр-прессы и барабанные вакуум-фильтры.
Наиболее энергоемким комплексом оборудования линии являются сушильные установки, представленные конвейерными ленточными сушилками, установками с виброкипящим слоем, а также вакуумными и сублимационными сушилками.
Завершающий комплекс оборудования линии состоит из машин для формования и завертывания брикетов дрожжей.
На рис. представлена машинно-аппаратурная схема линии производства хлебопекарных дрожжей.
Рис. Машинно-аппаратурная схема линии производства хлебопекарных дрожжей
Устройство и принцип действия линии. Из сборника 1 меласса насосом 2 направляется в рассиропник 3, в котором она разбавляется горячей водой (90 °С), выдерживается 30 мин и подается на кларификатор 5, где освобождается от механических примесей. Осветленное сусло нагревают до 120 °С в пластинчатом теплообменнике 4, выдерживают 30 с, охлаждают до 80 °С и направляют в приточный сборник 6, откуда подают в дрожжерастильные аппараты (8 — предварительный дрожжерастильный аппарат; 9, 10, 11 —дрожжерастильные аппараты соответственно I, II и II стадии маточных дрожжей). Осветление и стерилизация осуществляются в непрерывном режиме.
Минеральные соли (диамонийфосфат, сульфат магния, дестиобиотин и др. ) растворяют в бачке 7 и направляют в аппараты для размножения дрожжей 8п21 в строго определенных количествах.
) растворяют в бачке 7 и направляют в аппараты для размножения дрожжей 8п21 в строго определенных количествах.
Выращивание хлебопекарных дрожжей складывается из получения маточных и товарных дрожжей. Маточные дрожжи чистой культуры готовят в количестве, обеспечивающем засев непосредственно в товарный аппарат 21, и хранят в виде дрожжевого молока при температуре 2 °С. Перед засевом в товарный аппарат 21 маточные дрожжи подвергают жесткой обработке при рН 1,8…2,0 в течение 30 мин. Товарные дрожжи получают по периодической схеме без отборов среды.
Различия в технологии прессованных и сушеных дрожжей проявляются начиная с выделения и подготовки штамма и до получения товарной продукции. Они состоят в удельной скорости роста, засевов, длительности выращивания и концентрации сред.
Выросшие маточные и товарные дрожжи выделяют из дрожжевой суспензии, промывают холодной водой и сгущают в сепараторах 12, 14, 16 соответственно I, II, III ступени маточных и товарных дрожжей. Дрожжевое молоко после III ступени сепарации маточных и товарных дрожжей собирается в сборник 17, откуда направляется соответственно в сборники 18 и 22 — маточного и товарного дрожжевого молока.
Окончательное выделение товарных дрожжей из дрожжевого молока происходит в вакуум-фильтре 24, предварительно обработанном раствором поваренной соли из сборника 23. Пластины дрожжей из вакуум-фильтра 24 попадают в сушилку для дрожжей 26 через шнек 25, при этом пылевидная фракция улавливается в циклоне 27. Прессованные дрожжи формуются в брикеты и упаковываются.
Дрожжи: состав, виды и параметры, влияющие на активность. Тонкости применения дрожжей
Дрожжи применялись в хлебопечении в те далекие времена, когда еще не было известно ни об их существовании, ни о значении их при брожении. Уже в 17 веке пекари применяли пивную гущу для разрыхления теста, для ускорения процесса хлебопечения и улучшения качества хлеба. С 1767 г. пивные дрожжи стали широко применяться при в хлебопечении, и слава о них как об энергичном разрыхлителе хлебного теста распространилась по всему миру.
Пивные осадки представляли собой дрожжи верхового брожения. О видах и расах дрожжей ничего не было известно, растительная природа дрожжей и их состав были установлены в 1835-1836 гг. и несколько позднее благодаря усовершенствованию микроскопа и появлению методов выделения чистых культур микроорганизмов.
В 1850 г был открыт способ производства прессованных дрожжей для хлебопечения: это были дрожжи, получаемые на винокуренных заводах. Дрожжи, содержащиеся в пене, из бродильных чанов по желобам, размещенным вдоль чанов, поступали в дрожжевые сборники. Затем из промывали, смешивая с холодной водой в отстойниках, и полученный осадок выпрессовывали на винтовых прессах.
Открытие Луи Пастера о влияние кислорода воздуха на жизнедеятельность дрожжей и стремительное развитие машиностроения сделали возможным фабричное производство дрожжей. Так в 1872 году в городе Марк-ан-Бароль на севере Франции появился первый дрожжевой завод Lesaffre. С тех пор дрожжи стали основным продуктом исследования и производства концерна.
Дрожжи (Saccharomyces cerevisiae) – это микроорганизмы, относящиеся к группе одноклеточных грибов, которая объединяет около 1500 видов. Дрожжевые клетки имеют шаровидную или овальную форму, размером 3-7 мкм в диаметре. В 1 г живых дрожжей содержится 10 млрд. клеток. Это такое огромное количество что, если все клетки, содержащиеся в 0,5 кг дрожжей, выстроить в одну линию, образуется цепочка длиной 42 000 км. Это больше, чем один оборот вокруг Земли!
Из чего сделана дрожжевая клетка?
| Оболочка: 18% полисахариды(СВ) Клеточная мембрана: липиды, липопротеины, протеины Внутриклеточные составляющие: итоплазма, нуклиоли, органические соединения богатые белком, нуклеиновые кислоты и продукты их метаболизма, аминокислоты, пептиды, витамины |
Средний состав дрожжей
Сухие вещества: 30-33 %
Азот: 6,5-9,3 % (к СВ)
Белок: 40-58 %
Углеводы: 35-45 %
Жиры: 4-6 %
Минеральные вещества: 5-7,5 %
Витамины: B1, B2, B6, PP
Дрожжи могут существовать в различных условиях
В присутствии кислорода (аэробиоз) и питательных веществ (сахара) дрожжи потребляют O2 и глюкозу, производя CO2, воду и тепло. Энергия, производимая дрожжами потребляется для их воспроизводства. Эту реакцию используют производители дрожжей , производя дрожжи.
Энергия, производимая дрожжами потребляется для их воспроизводства. Эту реакцию используют производители дрожжей , производя дрожжи.
В отсутствие кислорода (анаэробиоз) — дрожжи бродят. Дрожжи трансформируют глюкозу в:
- CO2;
- спирт;
- вкусо-ароматические вещества;
- небольшое количество тепла.
Эту реакцию используют в хлебопечении.
Параметры, влияющие на активность дрожжей
1. Температура
2. Дозировка дрожжей
Чем выше дозировка дрожжей, тем быстрее идет брожение.
3. pH
От 4,5 до 6 оптимальный предел для дрожжевой активности. pH хлеба, изготовленного прямым способом, лежит в пределе 5.6 — 5.7.
4. Гидратация
Вода облегчает дрожжевую активность, растворяя сбраживаемые вещества и улучшая клеточную подвижность.
5.
 Концентрация и тип сахаров
Концентрация и тип сахаров
Виды дрожжей
Прессованные дрожжи
Прессованные дрожжи – это традиционная форма дрожжей. Прямоугольные блоки свежих дрожжей, расфасованные в разные виды упаковочных материалов (бумагу, фольгу, целлофан и т.п.). Этот тип дрожжей наиболее используемый в индустриальных странах.
Упакованные дрожжи выдерживают в холодильнике в течение 2-х дней, чтобы обеспечить равномерное охлаждение до температуры 4-7 градусов перед отправлением на склады холодильного отделения. Прессованные хлебопекарные дрожжи хранят в холодильных камерах при температуре 0-4 и относительной влажности воздуха 80-96%.
Из-за относительно высокой влажности прессованные дрожжи должны храниться при постоянной низкой температуре, иначе возможна потеря газообразующей способности. Температура длительного хранения составляет от 0 до 3 С. При температуре 7С дрожжи теряют 3-4% своей активности в неделю. Если дрожжи оставить на на хранения при температуре 35С они за 3-4 дня потеряют больше 50% своей активности и будут вызывать разжижение теста за счет мертвых дрожжевых клеток, содержащих глютатион.
Цвет прессованных дрожжей может варьироваться от темно-коричневого до почти белого цвета ,а текстура – от рассыпчатой до пластичной, мажущей. Внешний вид зависит от штамма дрожжей, источника мелассы, условий ферментации, содержания влаги и возраста дрожжей.
Сухие дрожжи
Сухие (сушеные) дрожжи имеют все преимущества, которыми обладают сухие продукты: стабильное качество, длительный срок хранения, широкий диапазон температурных режимов, простота транспортировки и хранения.
Сухие активные дрожжи
Производство сухих активных дрожжей осуществляется по технологии, используемой для прессованных дрожжей до этапа прессования.
Вместо прессования дрожжевую массу экструдируют через перфорированные пластины, получая из нее тонкие нити, которые разрезают на фрагменты. Затем полученный материал сушат в сушилках.
На практике коэффициент замены прессованных дрожжей на сухие активные подбирают по подъемной силе. Это соотношение обычно выше, чем можно было бы ожидать на основе сухого вещества. Газообразующая способность сухих активных дрожжей изначально ниже, чем у свежих, так как во время сушки происходят неизбежные потери жизнеспособных клеток.
Газообразующая способность сухих активных дрожжей изначально ниже, чем у свежих, так как во время сушки происходят неизбежные потери жизнеспособных клеток.
Инстантные сухие дрожжи
Эта форма сухих дрожжей отличается от обычных тем, что это легкосыпучий продукт, не требующий регидрации перед их добавлением в тесто. Благодаря низкой влажности одна часть может заменить три части прессованных дрожжей по массе.
Так же, как и другие виды сухих дрожжей, инстантные дрожжи не требуют специальных уловий хранения и сохраняют активность при комнатной температуре, пока пакет остался закрытым и под вакуумом. В этих условия потеря активности обычно не превышает 1% в месяц.
Инстантные дрожжи чувствительны к холодной воде во время регидрации. Это стоит учесть при замесе теста со льдом.
При использовании активных дрожжей продолжительность замеса обычно уменьшается. Это связно с вымываем из нежизнеспособных клеток глютатиона – восстановителя, который оказывает воздействие на белки клейковины. Но у инстантных дрожжей при сушке не формируется оболочка из дезактивированных клеток – источника глютатиона. Поэтому при работе на медленном тестомесильном оборудовании потребуется больше времени для того, чтобы гранулы инстантных дрожжей регидратировались и равномерно распределились по тесту по сравнению с прессованными.
Но у инстантных дрожжей при сушке не формируется оболочка из дезактивированных клеток – источника глютатиона. Поэтому при работе на медленном тестомесильном оборудовании потребуется больше времени для того, чтобы гранулы инстантных дрожжей регидратировались и равномерно распределились по тесту по сравнению с прессованными.
Осмотолерантные дрожжи
Осмотолерантные дрожжи идеально подходят для рецептур с высоким содержанием сахара. Осмотолерантные дрожжи богаты трегалозой (осмопротектор), что делает клетку более прочной «изнутри». С другой стороны за счет низкого содержания фермента инвертазы по сравнению с обычным штаммом, потребление дрожжами сахара происходит медленно и постепенно. Следовательно, в тесте, содержащим большое количество сахара, дрожжевая клетка сохраняет устойчивый метаболизм и ее ферментативные способности не нарушаются. Повышенное содержание трегалозы и глицерола компенсирует высокое осмотическое давление (давление на клетку «снаружи») снижается – основную причину гибели дрожжевых клеток.
Производство белорусских дрожжей. Официальный Российский сайт единственного в Беларуси Дрожжевого комбината.
Спиртовые и хлебопекарные дрожжи – одноклеточные организмы, которым для жизни не обязательно наличие кислорода. Их жизнедеятельность основана на процессе брожения, этим они отличаются от всех животных и растений, в организме которых осуществляется окисление. Не имея представления о микробиологии, люди издревле использовали это свойство дрожжей, чтобы получать полезные пищевые продукты. В библейской книге Бытие записано, что Ной умел делать винный напиток, а в книге Исход говорится о пресном и заквашенном тесте.
В искусстве виноделия и хлебопечения мало что изменилось с древних времен – сбраживание теста или плодово-ягодного сырья является обязательным. В пищевой промышленности закваску сегодня используют редко, гораздо чаще применяют сушенные или прессованные дрожжи. В личном хозяйстве любительницы выпечки и ценители домашнего вина тоже предпочитают использовать быстродействующие сухие экстракты дрожжевых культур. Достойное место на продовольственном рынке стран Таможенного Союза занимает продукция белорусского «Дрожжевого комбината».
Достойное место на продовольственном рынке стран Таможенного Союза занимает продукция белорусского «Дрожжевого комбината».
Единственный производитель дрожжей в Республике Беларусь
ОАО «Дрожжевой комбинат» является уникальной для Беларуси промышленной группой, единственным предприятием в своей отрасли. Основное направление деятельности компании – производство и продажа дрожжей, соответствующих нормативам ГОСТ. Комбинат предлагает широкий ассортимент дрожжей по доступной цене:
- прессованные и сухие хлебопекарные;
- винные и спиртовые;
- «Ростмомент» (регулятор роста и развития растений).
Прессованные пищевые дрожжи для выпечки хлеба – живая культура одноклеточных организмов, которая быстро запускает сбраживание теста, необходимо хранить в холоде. Сушеный продукт отличается только способом консервации: хлебопекарные дрожжи высушивают в ускоренном режиме, заставляя грибки впадать в неактивную форму. После попадания в жидкую среду высушенная культура возобновляет жизнедеятельность.
После попадания в жидкую среду высушенная культура возобновляет жизнедеятельность.
Культуры винных и спиртовых дрожжей в виде гранул или порошка используются для приготовления алкогольных напитков: настоек, вина, ликеров. Также этот продукт белорусского производства может быть применен для изготовления самогона.
«Ростмомент» – уникальная разработка специалистов комбината. Это экологически чистый регулятор и стимулятор жизнедеятельности растений. Получают его из дрожжей сахаромицетов и продуктов их жизнедеятельности. Аналогов у этого продукта нет не только в странах Таможенного Союза, но и вообще в мире.
«Дрожжевой комбинат» – достойный игрок на рынке Таможенного Союза ОАО «Дрожжевой комбинат» предлагает купить дрожжи оптом от производителя. Без ложной скромности заявляем, что наши дрожжи – лучшие на постсоветском пространстве, мы успешно осваиваем рынки сопредельных государств. Нашу продукцию можно приобрести в магазинах Москвы, Санкт-Петербурга, Самары, Новосибирска, Волгограда, Ростова и многих других городов России.
Мы добились успеха благодаря поступательному развитию, внедрению инноваций. Недаром наши хлебопекарные дрожжи называют «быстрые». Научные исследования и грамотная работа технологов позволили увеличить подъемную силу продукта. В то же время цена на белорусские дрожжи остается на демократичном уровне.
Мы всегда открыты для взаимовыгодного сотрудничества. Крупный, средний и мелкий опт, сеть супермаркетов или простой продуктовый магазин – мы рассматриваем любое предложение. Если вы ищете, где купить быстродействующие дрожжи оптом, обращайтесь к нам!
История нашего предприятия насчитывает уже более 120 лет. Опираясь на надежный фундамент прошлого, мы уверенно смотрим в будущее!
Производство дрожжей сухих оптом на экспорт. ТОП 50 экспортеров дрожжей сухих
Продукция крупнейших заводов по изготовлению дрожжей сухих: сравнение цены, предпочтительных стран экспорта.
- где производят дрожжи сухие
- ⚓ Доставка в порт (CIF/FOB)
- дрожжи сухие цена 21.
 01.2022
01.2022 - 🇬🇧 Supplier’s dry yeast Russia
Страны куда осуществлялись поставки из России 2018, 2019, 2020, 2022
- 🇲🇳 МОНГОЛИЯ (98)
- 🇰🇿 КАЗАХСТАН (51)
- 🇺🇸 СОЕДИНЕННЫЕ ШТАТЫ (44)
- 🇳🇴 НОРВЕГИЯ (32)
- 🇰🇬 КИРГИЗИЯ (25)
- 🇹🇯 ТАДЖИКИСТАН (21)
- 🇲🇩 МОЛДОВА, РЕСПУБЛИКА (21)
- 🇺🇦 УКРАИНА (13)
- 🇦🇿 АЗЕРБАЙДЖАН (13)
- 🇫🇷 ФРАНЦИЯ (8)
- 🇵🇱 ПОЛЬША (8)
- 🇨🇦 КАНАДА (7)
- 🇪🇪 ЭСТОНИЯ (6)
- 🇦🇲 АРМЕНИЯ (6)
- 🇹🇲 ТУРКМЕНИЯ (6)
Выбрать дрожжи сухие: узнать наличие, цены и купить онлайн
Крупнейшие экспортеры из России, Казахстана, Узбекистана, Белоруссии, официальные контакты компаний. Через наш сайт, вы можете отправить запрос сразу всем представителям, если вы хотите купить
дрожжи сухие.
🔥 Внимание: на сайте находятся все крупнейшие российские производители дрожжей сухих, в основном производства находятся в России. Из-за низкой себестоимости, цены ниже, чем на мировом рынке
Поставки дрожжей сухих оптом напрямую от завода изготовителя (Россия)
Крупнейшие заводы по производству дрожжей сухих
Заводы по изготовлению или производству дрожжей сухих находятся в центральной части России. Мы подготовили для вас список заводов из России, чтобы работать напрямую и легко можно было купить дрожжи сухие оптом
Мы подготовили для вас список заводов из России, чтобы работать напрямую и легко можно было купить дрожжи сухие оптом
Дрожжи пекарные
Изготовитель Дрожжи неактивные
Поставщики пищевые продукты
Крупнейшие производители Дрожжи активные культурные
Экспортеры Шампуни
Компании производители Прочее сухое печенье
Производство Дрожжи пекарные
Изготовитель хлебобулочные изделия не содержащие добавок в виде меда
Ученые стабилизировали колонию бактерий и дрожжей для производства топлива | Биотопливо
Исследователи из Принстона разработали технологию использования света. Она помогает контролировать рост колонии микроорганизмов световыми импульсами и стабилизировать ее состояние для более эффективного производства химикатов.
При совместном выращивании дрожжи и кишечная палочка обычно конкурируют, и самый быстрорастущий штамм побеждает другие. Это разрушает сообщество микроорганизмов и препятствует производству химических веществ. Команда ученых спроектировала колонию бактерий кишечной палочки (Escherichia coli) и пекарских дрожжей (Saccharomyces cerevisiae). В каждый штамм включили гены, ответственные за производство химических веществ. В частности, подразумевалось производство изобутилацетата — современного биотоплива, и нарингенина — противовоспалительного средства.
Команда ученых спроектировала колонию бактерий кишечной палочки (Escherichia coli) и пекарских дрожжей (Saccharomyces cerevisiae). В каждый штамм включили гены, ответственные за производство химических веществ. В частности, подразумевалось производство изобутилацетата — современного биотоплива, и нарингенина — противовоспалительного средства.
В первой колонии генетически модифицированная кишечная палочка превращает сахара в изобутанол, выделяемый в окружающую среду. Затем дрожжи поглощают этот изобутанол и превращают его в нужный конечный продукт — изобутилацетат.
Мы используем уникальные сильные стороны каждого организма. Кишечная палочка лучше производит простые строительные блоки, а дрожжи эффективнее превращают их в сложные молекулы
текст исследования
Такое разделение функций — идея не новая. Используя несколько микробов, исследователи избегают слишком обширных генетических модификаций в организме существа, которые в дальнейшем могут поставить под угрозу эффективность. Этот подход снижает нагрузку на отдельные клетки и оптимизирует метаболические процессы в организме.
Этот подход снижает нагрузку на отдельные клетки и оптимизирует метаболические процессы в организме.
Проблема же заключается в том, что штаммы не запрограммированы на совместную работу или эффективное сосуществование. Обычно, когда кишечная палочка и дрожжи выращивают вместе без контроля светом, палочка вытесняет дрожжи, потому что скорость ее роста намного выше.
Ранее уже предлагались элегантные решения, например создание условий, где два вида зависят друг от друга. Но такие стратегии строятся на расчете стартовых популяций, что затрудняет контроль роста и оптимизацию состава колоний для химического производства во время ферментации. Иными словами, даже если меняется стартовый состав и соотношения, нет никакого контроля над тем, что происходит дальше. Свет дает такой инструмент контроля.
В эксперименте команда не пыталась добиться определенного соотношения кишечной палочки и дрожжей или уровня производства топлива. Они хотели доказать принцип и продемонстрировать, что оптогенетика (применение света для контроля экспрессии генов) в принципе может использоваться, чтобы помочь культурам стабильно расти вместе в желаемом составе. А еще — улучшить производство представляющих интерес химических веществ. Оптогенетика ранее не использовалась для стабилизации совместно живущих культур. Обычно с помощью света изучают клеточные процессы, но применение света для контроля метаболизма становится все более популярным.
А еще — улучшить производство представляющих интерес химических веществ. Оптогенетика ранее не использовалась для стабилизации совместно живущих культур. Обычно с помощью света изучают клеточные процессы, но применение света для контроля метаболизма становится все более популярным.
Подвергая соседствующие культуры воздействию световых импульсов, исследователи определили условия, в которых производилось большее количество нужного химического вещества. К наиболее объемной выработке химикатов привели средние воздействия света. Исследование показало, что конечное производство изобутилацетата было на 83% выше при использовании светорегулируемого бактериального штамма по сравнению с использованием светочувствительного штамма.
Ученые заявили, что эта работа открывает двери для более широкого и успешного использования совместных культур в разных областях. Например, сообщества микробов могут пригодиться для биоремедиации, когда несколько организмов будут одновременно поедать разные загрязнители. Совместное культивирование также может быть полезно в сельскохозяйственных и пищевых технологиях, а также для изучения микробиомов.
Совместное культивирование также может быть полезно в сельскохозяйственных и пищевых технологиях, а также для изучения микробиомов.
Домашние дрожжи. Аэрация дрожжей и заквасок.
Домашние дрожжи сестер Турнипсид
Предыстория. В книге Бернарда Клайтона «Все о хлебе», по которой я пеку, есть несколько рецептов на домашних дрожжах. При этом как рецепты хлеба там разные, так и рецепты домашних дрожжей для того хлеба там разные. И не во всех случаях Клайтон приводит вариант для магазинных дрожжей в том же рецепте. Т.е. НУЖНЫ домашние.
Меня это вынуждает выводить и вести домашние дрожжи у меня на кухне. Рецепт-то хлеба попробовать хочется! И, конечно, все получается не так, как в книжке написано, или вообще не получается, и приходится копать, разбираться в вопросе. Так что, друзья мои, те, кто сейчас мучается с закваской, вы — не одиноки. У меня такие же трудности, только не с заквасками, в который я уже разбираюсь, а с домашними дрожжами!
Мои первые домашние дрожжи по рецепту сестер Турнипсид заняли не трое суток на свое выведение в полноценную рабочую форму, а целую неделю. Подозреваю, что и по другим рецептам домашних дрожжей в книгах Клайтона было бы то же самое. И в рецептах русских домашних дрожжей у Андреева (я приведу их позже ) — тоже.
Подозреваю, что и по другим рецептам домашних дрожжей в книгах Клайтона было бы то же самое. И в рецептах русских домашних дрожжей у Андреева (я приведу их позже ) — тоже.
Те дрожжи Турнипсид я одно время вела, регулярно раз в неделю кормила картошкой, а потом отвлеклась и забыла про них в углу холодильника на несколько месяцев ( картофельное пюре с дрожжами стояло в холодильнике с ноября по март!). На прошлой неделе я попыталась развести, раскормить их снова, чтобы продолжить печь по Клайтону, и они сначала встрепенулись и заработали как ни в чем ни бывало, а потом при последующих кормлениях пошли на убыль и сдохли и пришлось продолжать кормить безжизненную смесь свежей картошкой в надежде, что дрожжи снова там заведутся и размножатся.
А теперь собственно история. Естественно, там снова завелась какая-то живность из биоаэрозоля (из дрожжей в воздухе на кухне) и смесь стала вспухать, но никак не получались такие же красивые дрожжи как в первый раз для рецепта хлеба Турнипсид.
Получалась какая-то грубая расслаивающаяся смесь,
…которая никак не хотела превращаться в пышную льющуюся нежную пену — домашние дрожжи.
Тогда я почитала литературу по производству дрожжей и по диким дрожжам и спонтанным закваскам и выяснилось следующее.
1) Обычный сахар в питании для дрожжей — хорошо, а глюкоза — ещё лучше!
В магазинах у нас продают кристаллическую глюкозу под названием декстрозы («правосторонний» сахар, по ориентации молекулы).
Обычный сахар-песок дрожжи сначала расщепляют на глюкозу и фруктозу и потом им питаются, а декстрозу (глюкозу) они жрут напрямую, вообще без труда. Так что если вы выводите дома дрожжи или закваску, то добавки сахара, глюкозы, белого диастатического солода (он расщепляет крахмал на глюкозу), фруктовых соков (со своим набором сахаров), патоки, осахаренной или неосахаренной заварки, все оказывают немного разное влияние на размножение дрожжей и бактерий, на скорость и эффективность процесса.
Прием там такой. Вносят примерно 2-5% глюкозы к весу воды в смеси и через 8часов — ещё. Через 10 часов в смеси будет количество дрожжей, равное половине веса подмешанной глюкозы.
Вносят примерно 2-5% глюкозы к весу воды в смеси и через 8часов — ещё. Через 10 часов в смеси будет количество дрожжей, равное половине веса подмешанной глюкозы.
Т.е. если вы подмешали
2 ст.л. глюкозы (декстрозы) = 30г глюкозы
на 600г воды в которой сварили
500г вареной картошки и полстакана кукурузной муки,
то через 8ч в оптимальных условиях (см ниже) у вас разведется эквивалент 15г прессованных дрожжей в смеси и через 10ч (ещё через 2 часа) — 30г дрожжей в смеси. Мне этого на неделю выпечки запросто хватит, учитывая, что для опарного хлеба и сдобы из 500г муки надо совсем мало дрожжей.
2) Влияние температуры. Перегрев — страшное дело, в том, что касается дрожжей и вообще микроорганизмов.
Температура сильно влияет на селекцию разных микроорганизмов в смеси, потому что у всех — своя оптимальная Т размножения.
Это относится не только к микроорганизмам. Люди размножаются при 36.6С, так сказать. Если людей переохладить, скажем до 32-33С, все тело, насквозь, то вряд ли парочка размножится и женщина выносит ребенка в своей холодной утробе. И если у людей вызвать лихорадку сорока-сорокадвухградусную, то тоже — вряд ли произойдет как зачатие, так и развитие плода, не говоря уже о желании заняться сексом в сорокадвухградусную жару в комнате, когда тебя трясет от лихорадки и мозги спекаются от жара. Это понятно, что разница в 2-5 градусов даже в температуре человеческого тела и среды имеет огромное значение для размножения биологического вида. То же самое у бактерий и дрожжей.
И если у людей вызвать лихорадку сорока-сорокадвухградусную, то тоже — вряд ли произойдет как зачатие, так и развитие плода, не говоря уже о желании заняться сексом в сорокадвухградусную жару в комнате, когда тебя трясет от лихорадки и мозги спекаются от жара. Это понятно, что разница в 2-5 градусов даже в температуре человеческого тела и среды имеет огромное значение для размножения биологического вида. То же самое у бактерий и дрожжей.
Например, одна из самых ценных и важных бактерий в заквасках, МКБ сан-франциско, обожает 32С. Это для неё — настоящий рай. Число клеток этой МКБ удваивается каждые 45мин при 32С. Она полностью перестает размножаться при 41С. А при 12С размножается так медленно, что чуть ли не вечность и вообще не растет при 4С (в обычном холодильнике).
При 20-36С число клеток МКб сан-франциско удваивается примерно каждые полтора часа.
Для неё лучше среда, чуть прохладнее, чем оптимальная с Т 32С, чем чуть более горячая, чем 32С. Снижение Т закваски с 32С до 30С или до 28С практически мало влияет на скорость удвоения числа клеток МКБ сан-франциско. Подогрев с 32С до 34С и тем более до 36С резко тормозит размножение, при повышении температуры МКБ начинают тормозиться до бесконечности, размножаться бесконечно медленно, совсем никак…
Подогрев с 32С до 34С и тем более до 36С резко тормозит размножение, при повышении температуры МКБ начинают тормозиться до бесконечности, размножаться бесконечно медленно, совсем никак…
А вот бродит МКБ сан-франциско лучше всего (выделяет кислоты) при 34С. При 34С бактерия тормозит процессс размножения, перестает плодиться и садится кушать, интенсивно сбраживает сахар и крахмал в тесте и выделяет кислоты.
Для диких дрожжей и обычных хлебопекарных дрожжей, картина похожая, только со своими цифрами.
Самая главная дикая дрожжь, так сказать, Кандида миллери (она же торулопсия, она же сахаромицет минор, в разных классификациях), составляющая 60% всей массы дрожжей в заквасках, обожает размножаться при 28С. А хлебопекарные дрожжи, пивной сахаромицет, дикие и культурные штаммы, — при 30С, их число тогда удаивается каждые 75-90минут.
Прии 28С, количество клеток К. миллери удваивается каждый час. Она совершенно не размножается при 35С и при 8С. Так что не ставьте закваски на батареи и в холодильник, в надежде, что там что-то вырастет. Тесто может ВСПУХНУТЬ при таких температурах, ибо дрожжи живы и будут бродить, ВЫДЕЛЯТЬ ГАЗ, но они не будут РАЗМНОЖАТЬСЯ. Уж лучше пускай они при относительно прохладной комнатной температуре при 20-25С удваивают свое число каждые полтора-два часа, чем тормозятся до нуля на холоде или при невинных 35С — температуре прохладной человеческой руки!
Тесто может ВСПУХНУТЬ при таких температурах, ибо дрожжи живы и будут бродить, ВЫДЕЛЯТЬ ГАЗ, но они не будут РАЗМНОЖАТЬСЯ. Уж лучше пускай они при относительно прохладной комнатной температуре при 20-25С удваивают свое число каждые полтора-два часа, чем тормозятся до нуля на холоде или при невинных 35С — температуре прохладной человеческой руки!
Главная разница между брожением и размножением дрожжей в том, что и там и там дрожжи выделяют газ (тесто вспухает), но при брожении они ещё и спирт выделяют. А при размножении — никакого спирта, только ВОДУ.
В процессе брожения дрожжи выделяют газ и спирт. В процессе размножения дрожжи выделяют газ и воду. Если в среде (при оптимальной для размножения и брожения температуре) закончилось питание или накопилось слишком много спирта,то и брожение и размножение закончатся и дрожжи уснут, масса будет выглядет спокойной.
Ржаное тесто — как спокойная грязь, а пшеничное — как спокойная жижа или диск глины.
Дрожжи в ней спят (типа как холодные прессованные дрожжи спят в куске и сухие — в крупинках). Тесто выглядит как кусок подошвы (я его промяла, сдула), тесто этой закваски расти больше не будет, но оно — будучи концентратом МКБ и дрожжей — отлично заквасит свежую порцию теста или опару.
Спелая ржаная сан-франциска. То же самое. Это концентрат микроорганизмов, сожравших все что можно, максимально размножившихся (спелая закваска) и это ТЕСТО больше не поднимется. Тесто закваски промешано, не особо пористое, спокойное. Выглядит как густая кислая грязь и ничем особо не пахнет (спиртового аромата нет) и не благоухает (микроорганизмы ничего особенно не выделяют в летаргическом состоянии).
Вернемся к нашим баранам. К размножению дрожжей для рецептов Клайтона. Почитав литературу, я выяснила, что размножение при низких (неоптимальных) температурах возможно, но оно здорово влияет на то, как дрожжи потом будут бродить в тесте! Дрожжи , которые размножали при умеренной Т или в прохладе, скажем, при 15С, медленнее поднимают тесто (при любой Т теста), чем дрожжи, которые размножали при 28-30С!!!
Для нас, домашних хлебопеков, это имеет значение в том смысле, что
— нельзя полагаться на растянутое размножение заквасок в прохладе или на холоде между выпечками постоянно.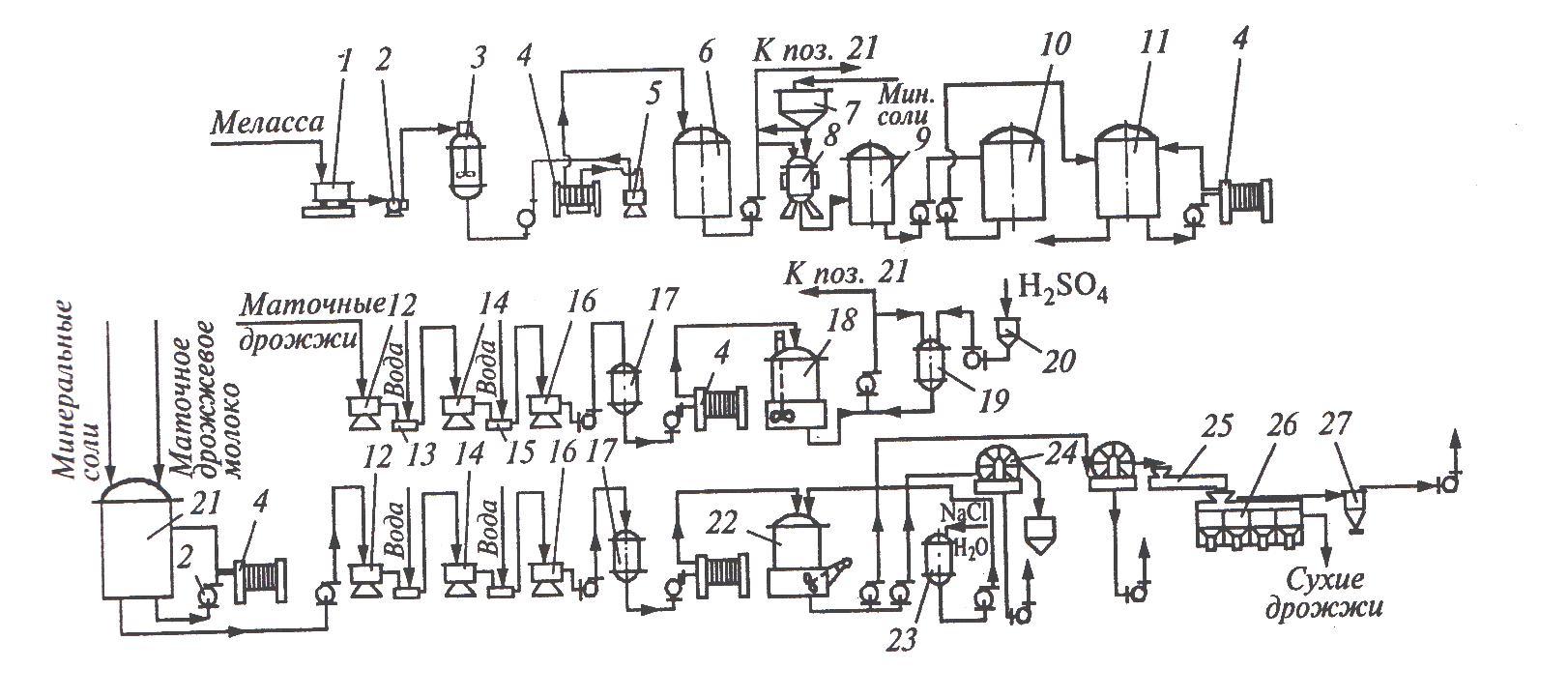 Нужно время от времени давать им размножаться при 28-30С до максимума несколько раз, чтобы сохранять могучую подъемную силу дрожжей.
Нужно время от времени давать им размножаться при 28-30С до максимума несколько раз, чтобы сохранять могучую подъемную силу дрожжей.
Многие люди замешивают закваски (кормят закваски свежим тестом), дают им чуток постоять в тепле и ставят в холодильник, чтобы они там продолжили «расти, размножаться и созревать», доходить до кондиции. А потом берут закваску из холодильника и используют в тесте. Такое обращение с размножением микробов производит с ними селекцию и в ней выводятся медленные дрожжи. Подъемная сила закваски снижается не потому, что в ней меньше клеток дрожжей, а потому что штамм в ней вывелся медленный, производящий мало газа в минуту даже в тепленьком тесте с сахарком!
— дрожжи, которые выводят дома, в тепле, часто неспособны перенести холод. Поэтому процесс выведения дрожжей должен включать в себя промежуточный шаг помещения дрожжей в холодильник.
Скажем, в рецепте Турнипсид для домашних хмелевых дрожжей, не просто дают дрожжам размножиться в картошке, эту смесь затем ставят на холод на двое суток и только потом смотрят, как она поднимает тесто и, если недостаточно, то продолжают размножать тот подвид, который выжил в холодной картошке в холодильнике.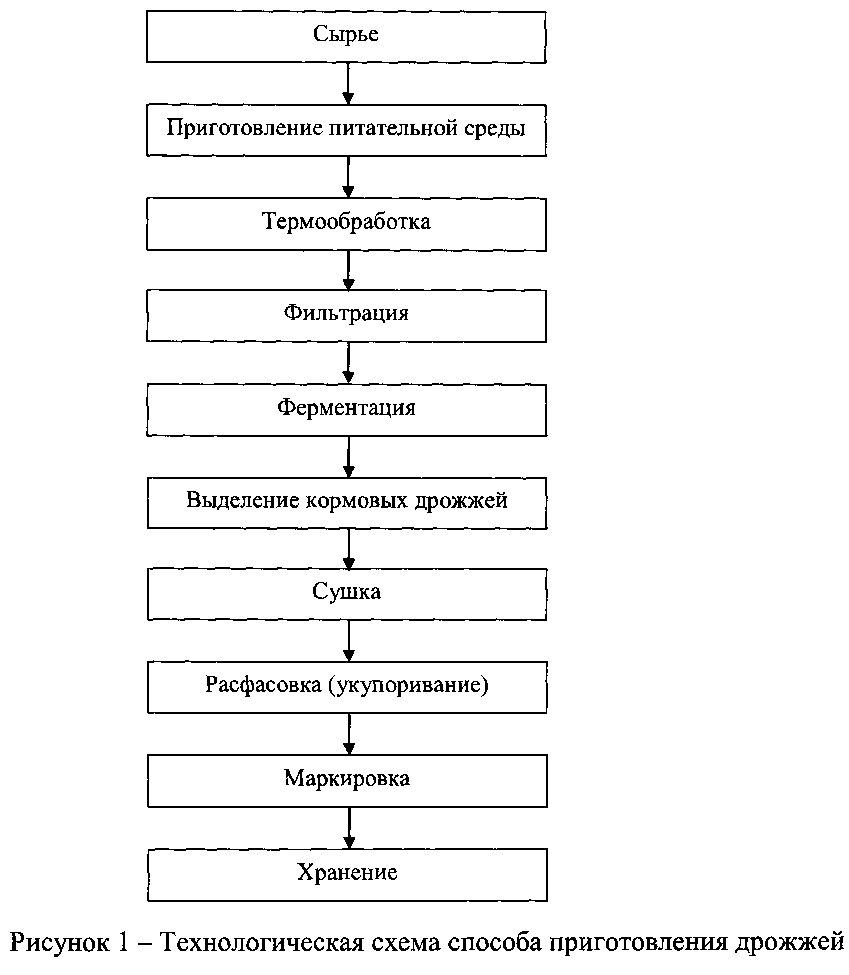 Часть штаммов дрожжей не вынесет пребывания на холоде (теплолюбивые) и исчезнут, а остальные — выживут и будут пригодны как для хлеба, так и для хранения дрожжей/заквасок на холоде между выпечками и именно их надо настойчиво размножать серией кормлений, чередуя с помещением в холодильник на пару суток и до недели.
Часть штаммов дрожжей не вынесет пребывания на холоде (теплолюбивые) и исчезнут, а остальные — выживут и будут пригодны как для хлеба, так и для хранения дрожжей/заквасок на холоде между выпечками и именно их надо настойчиво размножать серией кормлений, чередуя с помещением в холодильник на пару суток и до недели.
Поскольку продолжительность жизни дрожжевых клеток в среднем равна 8 суткам, дольше недели без подкормки дрожжи и закваски на холоде лучше не хранить. Именно такими были первые прессованные дрожжи, исторически говоря. Они выдерживали примерно неделю хранения в холодильнике ( в 1920х-1930х годах, когда появились в продаже домашние холодильники). Потом сроки хранения прессованных довели селекцией штаммов дрожжей до месяца, а сейчас прессованные дрожжи состоят из рас дрожжей, выдерживающих до двух месяцев в холодильнике.
3) Аэрация. Влияние помешивания среды и подвода к ней воздуха на процесс брожения и размножения дрожжей и бактерий невозможно переоценить.
Вся фишка заключается в том, что подвод кислорода к среде, где живут дрожжи, переключает дрожжи с процесса брожения на процесс размножения! Дрожжи встают из-за стола, так сказать, и начинают бешено плодиться в присутствии кислорода.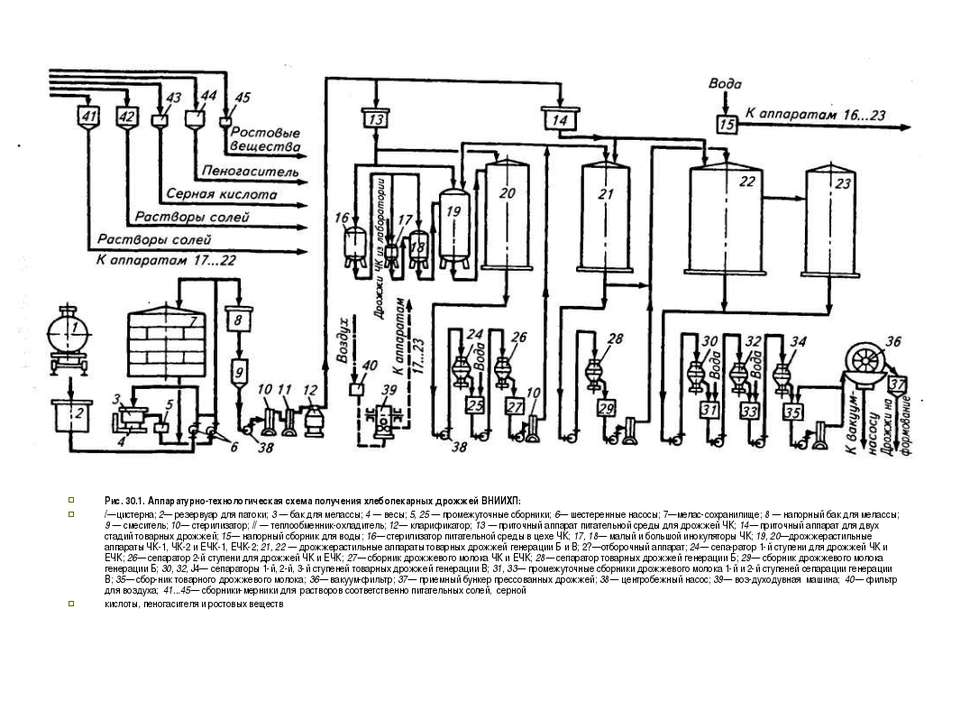
А в заквасках аэрация смеси позволяет увеличить производство бактериями уксусной кислоты в 2.5 раз, а молочной кислоты — на 30%. Она позволяет получить в три раза более более кислую закваску, опару или хлеб, если вам этого хочется. И размножаются бактерии лучше при подводе кислорода, при перемешивании. Оптимальная Т + перемешивание с проветриванием закваски = бурное размножение нужных бактерий ИЛИ бурное производство кислоты. Все зависит от того, для чего температура оптимальна, для размножения — своя Т (32С) , а для брожения — своя Т (34С).
Помешивайте ваши домашние дрожжи и закваски, ради бога, я вас умоляю! Не оставляйте их в покое, мешайте их! Это им не мешает, это им помогает! Особенно хорошо тем из нас, у кого есть самые дешевые и плохие миксеры, способные спокойно перемешивать жидкое тесто или картофельное пюре часами, поддавая домашним дрожжам или закваске кислороду. Более навороченные агрегаты, к сожалению, имеют таймер и на бесконечное перемешивание часами их не включишь.
У меня есть хлебопечка и она, умница, и подогревает холодную массу дрожжей или закваски (скажем, из холодильника) до 28-30-32С, и перемешивает в течение получаса безостановочно. Так что мои домашние дрожжи бурно размножились, просто невероятно, когда я поместила их в ведерко хлебопечки и поставила их там размножаться, перемешиваясь.
На фото дрожжи по рецепту сестер Турнипсид размножаются с перемешиванием в хлебопечке. Смесь из картофельного пюре, заваренной кукурузной муки, соли и декстрозы (глюкозы). Спонтанное сбраживание при 28-30С в течение двух суток (можно было сократить и этот шаг, но я тогда не знала! ), потом 2 суток на холоде (2-6С), потом вот это размножение того, что выжило на холоде в концентрированную дрожжевую массу — домашние дрожжи.
За три раунда перемешиваний по 30мин каждый дрожжи из холодильника согрелись с 4С до 28С. Рядом с хлебопечкой я поставила вентилятор, чтоб охлаждать её корпус и мотор от перегрева, и в последующие раунды перемешиваний каждые полчаса вынимала дежу, давала ей остыть несколько минут под вентилятором до безопасных для микробов 25-26С и снова включала перемешивание на полчаса.
Хлебопечка поддерживала Т домашних дрожжей не выше 30С, максимум 31С.
Готовые дрожжи надо перелить в посуду с большим запасом пустого пространства,
…потому что пока они не остыли и не тормознулись холодом, они попрут как бешеные . Те же дрожжи через 15 мин в холодильнике.
Надо несколько раз доставать банку, в процессе остывания дрожжей (или заквасок), ставить банку в глубокую миску или тазик, на тот случай, что они вулканом бурно потекут из банки, перемешивать их, чтобы выпустить из смеси углекислый газ и пары спирта. И они со временем утихомирятся, остынут и уснут. И у нас будет готовый концентрат домашних дрожжей для выпечки, вместо магазинных или просто потому, что мы печем по старинным рецептам и хотим получить максимально аутентичный результат.
Домашние дрожжи по науке, дамы и господа.
Рецепты старинных русских и советских домашних дрожжей из Андрееа я отсканирую и выложу позже (или вы сами и в своей книжке Андреева посмотрите). Здесь уже места мало. Слишком много написала. Насколько я поняла, сам он не тестировал те рецепты и не улучшал, просто разместил копии текстов рецептов в своей книге без указания источников, даром что доцент и кандидат наук, уж больно разномастный стиль изложения в тех рецептах. Так что все их можно улучшить, сделать более эффективными и быстрыми, применяя методы, описанные выше — аэрацию и перемешивание, оптимальную температуру с промежуточным шагом в холодильнике, и глюкозу или мальтозную патоку и картофель, сильно стимулирующие дрожжи.
Здесь уже места мало. Слишком много написала. Насколько я поняла, сам он не тестировал те рецепты и не улучшал, просто разместил копии текстов рецептов в своей книге без указания источников, даром что доцент и кандидат наук, уж больно разномастный стиль изложения в тех рецептах. Так что все их можно улучшить, сделать более эффективными и быстрыми, применяя методы, описанные выше — аэрацию и перемешивание, оптимальную температуру с промежуточным шагом в холодильнике, и глюкозу или мальтозную патоку и картофель, сильно стимулирующие дрожжи.
Производство дрожжей, прессованные и сухие дрожжи — Львов
Испокон веков домашний хлеб и свежая выпечка были визитными карточками украинской семьи, непременным атрибутом семейного уюта. На сегодняшний день сложно представить приготовление ароматной домашней выпечки без «Львовских дрожжей», благодаря которым домашний хлеб и сдоба всегда получаются мягкими, рыхлыми и ароматными. Дрожжевая продукция «Компании Энзим» пользуется большой популярностью среди украинских хозяек и является неотъемлемой составляющей их кулинарного искусства. Дрожжи произведенные в Львове пользуются спросом для изготовления выпечки дома во многих странах Европы: Польша, Германия, Нидерланды, Чехия, Бельгия, Словакия, Словения, Хорватия, Венгрия, Болгария, Молдова, Румыния и других.
Дрожжи произведенные в Львове пользуются спросом для изготовления выпечки дома во многих странах Европы: Польша, Германия, Нидерланды, Чехия, Бельгия, Словакия, Словения, Хорватия, Венгрия, Болгария, Молдова, Румыния и других.
Хлебопекарные дрожжи «Компании Энзим» представлены прессованными и сухими быстродействующими дрожжами.
Своего потребителя в Польше нашли хлебопекарные дрожжи для домашнего выпекания Drożdże Lwowskie в фасовке 42 г и 100г. Drożdże Lwowskie можно найти в одном из крупнейших супермаркетов Польши.
Дрожжи в фасовке 42 г очень удобны для использования, поскольку адаптированы под большинство рецептов выпечки. Прессованные дрожжи в фасовке 100 г является классическим фасовкой, поскольку являются наиболее распространенными и чаще всего применялись для выпечки хлеба и сдобы по семейным рецептам от мам и бабушек.
Прессованные дрожжи – это продукт проверенный временем. Однако компания продолжает совершенствовать его качественные показатели, что позволяет потребителям тратить меньше усилий на выпечки хлебобулочных изделий за особо сложными рецептами. Прессованные дрожжи могут храниться до 35 дней. Весь этот период они не теряют способность поднимать тесто.
Прессованные дрожжи могут храниться до 35 дней. Весь этот период они не теряют способность поднимать тесто.
Сухие быстродействующие дрожжи проще в использовании, чем прессованные, поскольку не требуют предварительного растворения при температуре, их можно сразу добавлять в муку. Упаковка сухих «Львовских дрожжей» предусматривает более удобное хранение продукта, срок годности которого составляет 18 месяцев. Сухие быстродействующие дрожжи производят в фасовке 12 г и 100 г. Лучший показатель высокого качества наших дрожжей — это душистая и ароматная выпечка, которая является украшением каждого стола.
Как производятся пекарские дрожжи и какой тип использовать
Если у вас есть собственная закваска, поддерживаемая благодаря регулярной подкормке, вы выращиваете свои собственные микроорганизмы. Микроорганизмы окружают нас повсюду, в воздухе и на большинстве поверхностей. В большинстве случаев мы не хотим, чтобы они росли, например, из страха, что они испортят наши фрукты.
Однако в некоторых случаях вы хотите, чтобы он рос. Например, для приготовления закваски (или при приготовлении йогурта). И хотя использование собственной закваски — отличный способ испечь хлеб, это не всегда осуществимый вариант.К счастью, сегодня хлеб можно испечь, не имея собственной закваски. Можно просто купить дрожжи.
Но откуда берутся эти дрожжи? И какой из них вы должны использовать? Мгновенное, активное, свежее или, может быть, что-то еще?
Небольшое примечание: в этой статье мы сосредоточимся на пекарских дрожжах. Несмотря на то, что пивные дрожжи и другие действуют схожим образом, их использование и производство несколько отличаются.
Что мы будем освещать:
Что такое дрожжи
Дрожжи — микроорганизмы, состоящие всего из одной клетки.Клетки дрожжей растут совсем по-другому и намного быстрее, чем животные (например, люди). Они могут расти в процессе, называемом почкованием, при котором маленькая дрожжевая клетка растет снаружи зрелой клетки, пока она полностью не вырастет и не будет готова к отделению. Для того чтобы дрожжи росли тем или иным образом, им необходимо достаточное количество пищи (в основном сахаров) и благоприятные условия. Температура должна быть приемлемой, равно как и рН (мера кислотности) и наличие (или отсутствие) кислорода.
Для того чтобы дрожжи росли тем или иным образом, им необходимо достаточное количество пищи (в основном сахаров) и благоприятные условия. Температура должна быть приемлемой, равно как и рН (мера кислотности) и наличие (или отсутствие) кислорода.
Мы используем дрожжи для приготовления различных продуктов.Без дрожжей не было бы вина, пива и большого количества хлеба. Дрожжи могут превращать сахар в спирт посредством процесса, называемого ферментацией. Дрожжи также могут выделять углекислый газ, который гарантирует, что ваш хлеб поднимется во время расстойки.
Существует множество различных видов дрожжей. Вид дрожжей, которые вы используете для приготовления хлеба, пекарских дрожжей, называется Saccharomyces cerevisiae . В настоящее время производители могут выращивать этот вид дрожжей строго контролируемым образом, что дает вам легкий доступ к полезному ингредиенту.
Если вы хотите узнать больше об основах дрожжей, посмотрите наш урок на эту тему.
Видите все эти воздушные карманы? У вас есть дрожжи, чтобы поблагодарить за них.
Как делают дрожжи
Дрожжи – это живые микроорганизмы. Таким образом, производство — это не простой стандартный химический процесс или разделение. Вместо этого, чтобы сделать дрожжи, вам нужно их вырастить. Несмотря на то, что вы можете достаточно хорошо контролировать рост, этот процесс менее стабилен и его труднее контролировать, чем стандартную химическую реакцию.
Преимущество выращивания дрожжей в том, что вам не нужно много для начала. Вам не нужно «делать» дрожжи. Вместо этого вы начинаете с существующей культуры дрожжей. Производители могут получать эти культуры из разных мест. В большинстве случаев они получают дрожжи из предыдущих партий. Эти штаммы тщательно поддерживаются и заботятся о них, чтобы обеспечить идеальную отправную точку для еще одной партии.
Saccharomyces cerevisiae существует в природе вокруг нас, поэтому его также можно выделить из содержащего его продукта.Вы используете этот метод выращивания дрожжей при приготовлении собственной закваски.
Информационный бюллетень
Хотите быть в курсе новых статей о пищевых продуктах? Подпишитесь на нашу еженедельную рассылку
Выращивание дрожжей – начнем с малого
Производители дрожжей имеют обширные запасы видов дрожжей, необходимых им для выращивания. Когда им нужно произвести больше клеток определенного типа, они начинают с того, что берут несколько клеток этого штамма.
Производители точно знают, в каких условиях эти дрожжи растут хорошо, а в каких нет.Они помещают дрожжевые клетки в колбу, на данный момент еще довольно маленькую колбу. Они добавляют много воды и пищи, как правило, сахарной свеклы или патоки сахарного тростника. Убедитесь, что дрожжи получают достаточное количество кислорода, и поддерживайте предпочтительную для дрожжей температуру. Оттуда дрожжи начинают расти и заполняют эту колбу дрожжевыми клетками.
При выращивании дрожжей таким способом важно, чтобы дрожжи получали достаточно кислорода. Если кислорода будет недостаточно, он начнет бродить. В результате брожения образуется спирт, что не способствует дальнейшему росту дрожжей.
Если кислорода будет недостаточно, он начнет бродить. В результате брожения образуется спирт, что не способствует дальнейшему росту дрожжей.
Становится большим
Как только в первой колбе будет достаточно дрожжей, дрожжи переливают в колбу большего размера. Его снова подкармливают и оставляют расти. С этого момента дрожжи перемещаются во все более крупные емкости для выращивания. Последний резервуар может содержать тысячи литров жидкости, наполненной дрожжами.
Не дайте себя обмануть, в данный момент этот резервуар в основном состоит из воды. Лишь несколько процентов от общего веса составляют дрожжи. Дрожжам нужно много воды, кислорода и пищи для роста, поэтому, как только они станут слишком концентрированными, они больше не будут расти.
Возможно, вам интересно, почему вы не можете просто поместить дрожжи в этот маленький резервуар для начала. Это потому, что производителю действительно сложно создать идеальные условия для выращивания небольшого количества дрожжей в огромном резервуаре. Поэтапное масштабирование повышает контроль и эффективность процесса.
Поэтапное масштабирование повышает контроль и эффективность процесса.
Проблемы производства дрожжей
Когда вы выращиваете дрожжи, вы хотите создать идеальные условия для их роста. К сожалению, в таких условиях есть много микроорганизмов, которые тоже любят расти.При производстве дрожжей очень важно, чтобы эти нежелательные бактерии даже не попали в помещение. Вот почему пища для дрожжей, патока, стерилизуется перед использованием. Кроме того, общая гигиена необходима на протяжении всего процесса.
Закваски для закваски – вырастите сами
Некоторые пекарни получают дрожжи из этих больших резервуаров. Но другие делают свои собственные, поддерживая стартер на закваске. Эта закваска содержит не только дрожжи, но и множество других микроорганизмов, таких как бактерии.Он отлично подходит для приготовления хлеба.
То, что вы делаете при обслуживании стартера, по сути, то же самое, что и при выращивании дрожжей в резервуарах. Однако вместо того, чтобы выращивать свой контейнер, вы постоянно выбрасываете часть закваски. По сути, вы делаете то же самое, поддерживая условия выращивания для микроорганизмов как можно более идеальными.
По сути, вы делаете то же самое, поддерживая условия выращивания для микроорганизмов как можно более идеальными.
Сухие дрожжи
В последнем резервуаре процветают дрожжи. Он очень активен и счастливо растет. Он будет готов к использованию для приготовления хлеба или другого дрожжевого продукта. Однако, как только корм в аквариуме заканчивается, активность дрожжей может быстро снизиться. В какой-то момент дрожжи отомрут.
Чтобы сохранить активность этих дрожжей, производители дрожжей сушат. Вы можете либо полностью высушить их, что сделает их стабильными при хранении в течение нескольких месяцев или лет.Или вы можете сконцентрировать их ровно настолько, чтобы сохранить им жизнь при транспортировке на фабрику, где они будут использоваться для выполнения своей работы.
Кремовые дрожжи
Первым этапом концентрирования дрожжевого бульона является центрифугирование. Центрифуги используют разницу в плотности для отделения дрожжевых клеток от части жидкости. Это система, аналогичная той, которая используется для отделения сливок от молока.
Центрифуги используют разницу в плотности для отделения дрожжевых клеток от части жидкости. Это система, аналогичная той, которая используется для отделения сливок от молока.
После центрифугирования количество дрожжей в смеси остается довольно низким, <20%.Это сливочные дрожжи. Его нельзя купить в обычных магазинах и супермаркетах. Вместо этого его напрямую транспортируют в пекарни. Дрожжи все еще очень активны, поэтому их нельзя хранить очень долго. Перевозя его в охлажденном состоянии, его можно хранить достаточно долго, пока он не будет использован.
Свежие дрожжи / дрожжи для выпечки
Далее дрожжи еще больше концентрируются. Например, производители могут использовать для этого оборудование для вакуумной сушки.
В этот момент содержание дрожжей увеличилось до 30-35% (от <20% в сливочных дрожжах).Если спрессовать их вместе в блоки, получится то, что вы бы назвали свежими дрожжами. Свежие дрожжи продаются в пекарнях и некоторых супермаркетах. Они менее активны, чем кремовые дрожжи, но их все равно нужно хранить в холодильнике, чтобы они оставались живыми достаточно долго. В зависимости от типа дрожжей общий срок годности составляет всего около 4 недель.
В зависимости от типа дрожжей общий срок годности составляет всего около 4 недель.
Полусухие дрожжи
Поскольку дрожжи, как правило, все еще недостаточно сухие, дрожжи дополнительно высушиваются. Способ сделать это с помощью гранулятора и осушителя воздуха.Эти дрожжи, также называемые полусвежими дрожжами, содержат всего 20% влаги. Эти дрожжи все еще очень активны и хранятся в морозильной камере, чтобы гарантировать, что они останутся активными достаточно долго.
Сухие дрожжи
Дальнейшая сушка дрожжей дает сухие дрожжи. Это дрожжи, которые вы найдете в супермаркетах. Дрожжи высушиваются в крошечные гранулы, и вы можете легко зачерпнуть их из чашки. Содержание влаги в этот момент упало до <5%. Обычно эти дрожжи можно хранить до двух лет при комнатной температуре.
Пищевые дрожжи
Пищевые дрожжи на самом деле не относятся к этому списку, но мы добавляем их просто для ясности. Этот тип дрожжей больше не является активным и живым. Он был деактивирован намеренно. Таким образом, вы не можете использовать его для расстойки хлеба и т. д. Вместо этого вы используете пищевые дрожжи, чтобы придать вкус своей еде. Он обеспечивает глубину, добавляя умами к вашей еде.
Таким образом, вы не можете использовать его для расстойки хлеба и т. д. Вместо этого вы используете пищевые дрожжи, чтобы придать вкус своей еде. Он обеспечивает глубину, добавляя умами к вашей еде.
Выбор дрожжей
Если вы не профессиональный пекарь, шансы, что вы когда-либо будете использовать сливочные дрожжи или полусухие дрожжи, очень малы.Ваши варианты либо свежие, либо сухие дрожжи.
Свежие дрожжи подойдут, однако в холодильнике они хранятся всего несколько недель. Если вы не печете часто, трудно использовать его вовремя. Для большинства рецептов вы можете заменить свежие и сухие дрожжи. Имейте в виду, что свежие дрожжи содержат намного больше воды, чем сухие дрожжи. Поэтому вам нужно намного больше свежих дрожжей. Как правило, используйте в три раза больше свежих дрожжей, чем сухих, или следуйте рекомендациям в вашем рецепте или на упаковке дрожжей.
При использовании сухих дрожжей есть еще один вариант. Есть несколько типов на выбор. В США наиболее распространены активный сухой, мгновенный и быстрый подъем (или аналогичное название, это, как правило, торговые марки). За пределами США наиболее распространены быстрорастворимые дрожжи. Прочитав инструкции о том, как использовать ваши дрожжи, и приведенное ниже руководство, вы сможете определить, какие из трех это.
Есть несколько типов на выбор. В США наиболее распространены активный сухой, мгновенный и быстрый подъем (или аналогичное название, это, как правило, торговые марки). За пределами США наиболее распространены быстрорастворимые дрожжи. Прочитав инструкции о том, как использовать ваши дрожжи, и приведенное ниже руководство, вы сможете определить, какие из трех это.
Активные сухие дрожжи
Активные сухие дрожжи необходимо активировать перед использованием.Вы делаете это, растворяя часть его в чуть теплой воде. Дрожжи регидратируются и начинают пузыриться, что означает, что они готовы к использованию.
Основной причиной регидратации активных дрожжей является их большой размер гранул. Эти большие кусочки затрудняют полную регидратацию дрожжей и поглощение достаточного количества воды. Поместив его в воду заранее, он легко получает доступ к достаточному количеству влаги.
Активные сухие дрожжи менее стабильны, чем более современные разновидности. Таким образом, предварительная проверка дрожжей является хорошим тестом, чтобы увидеть, достаточно ли они активны. Если не пузырится, то уже нет.
Если не пузырится, то уже нет.
Несмотря на то, что это общий совет при использовании активных сухих дрожжей, некоторые из современных разновидностей активных сухих дрожжей прекрасно работают без какой-либо предварительной гидратации. Вы можете использовать их так же, как и быстрорастворимые дрожжи.
- Быстрорастворимые дрожжи
- Активные сухие дрожжи
Быстрорастворимые дрожжи
За прошедшие годы технологии сушки дрожжей значительно улучшились. Именно это позволило производить быстрорастворимые дрожжи.Они аналогичны активным сухим дрожжам, однако их не нужно предварительно активировать. Вместо этого вы можете просто добавить его к остальным ингредиентам.
Все дрожжи имеют свои идеальные условия для роста. Некоторые дрожжи плохо растут при большом количестве сахара, в то время как другие, называемые осмотолерантными дрожжами, вообще не возражают против сахара. Вот почему вы можете найти в продаже различные типы растворимых дрожжей. Как правило, эти разновидности есть в наличии только в специализированных (интернет) магазинах.При увеличении масштаба могут быть полезны различные типы дрожжей. В небольших масштабах вы часто можете решить проблему, увеличив время заквашивания или добавив больше дрожжей.
Как правило, эти разновидности есть в наличии только в специализированных (интернет) магазинах.При увеличении масштаба могут быть полезны различные типы дрожжей. В небольших масштабах вы часто можете решить проблему, увеличив время заквашивания или добавив больше дрожжей.
Быстрый подъем
Еще более поздней разработкой являются дрожжи Rapidrise или Quickrise. Эти дрожжи очень активны, как следует из названия. Таким образом, они могут довольно быстро поднять продукт, но на самом деле они хорошо работают только для одного подъема. Так что, если вы печете хлеб, который нужно расстойки дважды, эти дрожжи не подойдут.Он не сможет запустить этот второй подъем.
Использование пекарских дрожжей
Простой эксперимент с дрожжами. Все чашки содержат одинаковое количество дрожжей, муки и воды. Однако в левой чашке также есть немного сахара, а в средней — немного соли. Понятно, что присутствие соли замедляет рост, а присутствие сахара ускоряет его! Дрожжи – это живые микроорганизмы.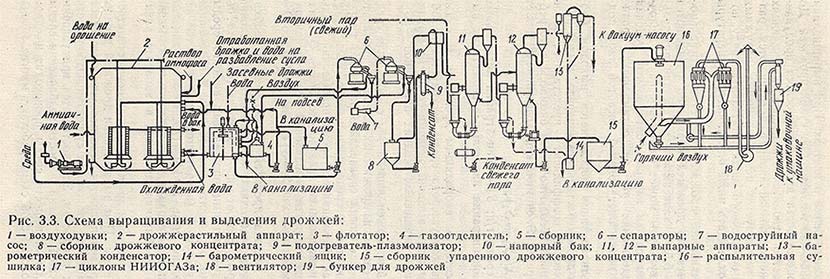 Чтобы убедиться, что он действительно заквашивает ваш хлеб или пирожные, вам нужно хорошо с ним обращаться.
Чтобы убедиться, что он действительно заквашивает ваш хлеб или пирожные, вам нужно хорошо с ним обращаться.
Температура : пекарские дрожжи лучше всего растут при температуре около 30-35°C. Вот почему рецепты советуют поставить тесто в теплое место для расстойки. Однако не увлекайтесь слишком сильно. При температуре выше примерно 40°C начинает отмирать. Вот почему в рецептах никогда не будет необходимости добавлять горячую воду в тесто, требующее расстойки, это убьет дрожжи.
При температуре ниже оптимальной дрожжи все равно будут расти. Однако он просто будет расти медленнее. Для некоторых рецептов это действительно желательно, более медленный и длительный процесс также приводит к образованию большего количества аромата, производимого дрожжевыми клетками.
Соль : дрожжи плохо растут в присутствии большого количества соли. Как вы можете видеть на изображении выше, соль значительно замедляет рост. Вам нужно будет сбалансировать потребность в аромате соли с потребностью в быстром (или медленном) росте.
Сахар : сахар является отличным источником пищи для дрожжей. Дрожжи могут расти из углеводов, содержащихся в пшеничной муке, но чистый сахар более доступен и действительно может ускорить их рост.
Концентрация : если вы начнете с большего количества дрожжей, вы быстрее получите большой объем дрожжей.Кроме того, большие объемы производят больше газов, которые заквашивают ваш хлеб. Тем не менее, добавьте слишком много, и дрожжи слишком быстро закончатся, а также в хлебе, который легко передержать.
Будь то закваска, свежие или сухие дрожжи. Во всех случаях вы имеете дело с живым микроорганизмом, который помогает вам приготовить вкусную еду (и напитки). Относитесь к нему хорошо, и он будет хорошо относиться к вам, что должно быть легче теперь, когда вы знаете, откуда оно взялось.
Хлеб слева поднялся с нужным количеством дрожжей.Хлеб справа поднялся на слишком большом количестве дрожжей, в результате дрожжи уже закончили расти задолго до того, как хлеб попал в печь. Таким образом, он больше не расширяется в духовке.
Таким образом, он больше не расширяется в духовке.Ссылки
Angel Yeast, Процесс производства пекарских дрожжей Angel, ссылка
Моника Б., Промышленное производство пекарских дрожжей: процесс, принципы и история | Промышленная микробиология, обсуждение биологии, ссылка
Пищевая и сельскохозяйственная промышленность, глава 9, раздел 9.13.4 Дрожжевое производство, ссылка
Lallemand, Дрожжевое производство, том 3, номер 4, ссылка
Lesaffre, Как делаются дрожжи — Lesaffre, 11 сентября 2018 г., ссылка
Мука короля Артура, дрожжи 101, ссылка
Дрожжи Red Star, Наука о дрожжах, ссылка
Stella Parks, Все о сухих дрожжах: растворимые, активные сухие, быстродействующие и другие, 4 ноября 2019 г., Serious Eats, ссылка
Производство и характеристика дрожжей, выращенных на среде, состоящей из хвойных сахаров и белковых гидролизатов из куриных субпродуктов | Microbial Cell Factory
Материалы
Свежие куриные субпродукты (сердце, печень и желудочно-кишечный тракт) были предоставлены Nortura Hærland (Hærland, Норвегия) и хранились при температуре - 20 °C до дальнейшего использования. Перед реакциями ферментативного гидролиза образцы размораживали и измельчали с помощью измельчителя кормов BIRO ® MODEL 6642 (Marblehead, Ohio, USA). Куриные субпродукты содержали 30,12 ± 0,50 % сухого вещества, в том числе 15,10 ± 1,20 % белка, 4,47 ± 0,29 % золы и 6,91 ± 0,55 % липидов [20]. Ферментативные гидролизаты предварительно обработанной BALI™ древесины ели ( Picea abies ) были любезно предоставлены компанией Borregaard AS (Sarpsborg, Норвегия) [16]. Сырьем, используемым в процессе варки целлюлозы, была ельовая щепа с размером щепы до 4.5 × 4,5 × 0,8 см 3 . Углеводный состав гидролизата ели показан в дополнительном файле 1: Таблица S1. Приобретены дрожжевой экстракт, мясной пептон, азотная основа дрожжей без аминокислот и без сульфата аммония, глюкоза, целлобиоза, ксилоза, молочная кислота, уксусная кислота, серная кислота, хлористый водород, гидроксид натрия, нингидрин, глицин и хлорид олова. от Sigma-Aldrich (Миссури, США). Сульфат аммония был приобретен у VWR (Пенсильвания, США), а мочевина была любезно предоставлена Yara International ASA (Осло, Норвегия).
Перед реакциями ферментативного гидролиза образцы размораживали и измельчали с помощью измельчителя кормов BIRO ® MODEL 6642 (Marblehead, Ohio, USA). Куриные субпродукты содержали 30,12 ± 0,50 % сухого вещества, в том числе 15,10 ± 1,20 % белка, 4,47 ± 0,29 % золы и 6,91 ± 0,55 % липидов [20]. Ферментативные гидролизаты предварительно обработанной BALI™ древесины ели ( Picea abies ) были любезно предоставлены компанией Borregaard AS (Sarpsborg, Норвегия) [16]. Сырьем, используемым в процессе варки целлюлозы, была ельовая щепа с размером щепы до 4.5 × 4,5 × 0,8 см 3 . Углеводный состав гидролизата ели показан в дополнительном файле 1: Таблица S1. Приобретены дрожжевой экстракт, мясной пептон, азотная основа дрожжей без аминокислот и без сульфата аммония, глюкоза, целлобиоза, ксилоза, молочная кислота, уксусная кислота, серная кислота, хлористый водород, гидроксид натрия, нингидрин, глицин и хлорид олова. от Sigma-Aldrich (Миссури, США). Сульфат аммония был приобретен у VWR (Пенсильвания, США), а мочевина была любезно предоставлена Yara International ASA (Осло, Норвегия). Кьелтабы для анализа Кьельдаля были приобретены у Thomson and Capper Ltd. (Чешир, Великобритания).
Кьелтабы для анализа Кьельдаля были приобретены у Thomson and Capper Ltd. (Чешир, Великобритания).
Ферментативный гидролиз куриных побочных продуктов
15 кг (влажный вес) измельченных куриных побочных продуктов смешивали с 15 л воды в 30-литровых реакторах гидролиза Einar (Belach Bioteknik, Skogås, Стокгольм, Швеция), в результате чего получали сухой -концентрация вещества 15%. Ферментативный гидролиз куриных субпродуктов проводили с использованием 0,5% (масса ферментного порошка/масса влажных куриных субпродуктов) папаина из Carica papaya (≥ 3 ед./мг; Merck, Дармштадт, Германия). при 60°С и 50 об/мин без регулировки рН и с использованием медленного нагрева до 60°С, как описано ранее [20].Гидролизаты удаляли из резервуаров для гидролиза через 2 часа и фильтровали через сито диаметром 0,85 мм для удаления нерастворимых частиц. Впоследствии гидролизаты охлаждали до 4 °C и хранили в течение ночи, что приводило к накоплению липидов на поверхности гидролизата. Жидкую фракцию центрифугировали на центрифуге Beckman Coulter Avanti J-26S XP (Индианаполис, Индиана, США) при 4°С и 10 000 g в течение 10 мин. Наконец, гидролизаты куриных побочных продуктов (CH) фильтровали через сито с диаметром 75 мкм и хранили при - 20 °C до использования.Из-за большого объема гидролиза (15 кг сырья и 15 кг воды) инактивацию протеолитических ферментов проводили не сразу после гидролиза, а путем автоклавирования определенных аликвотных объемов, используемых при приготовлении ферментационных сред.
Наконец, гидролизаты куриных побочных продуктов (CH) фильтровали через сито с диаметром 75 мкм и хранили при - 20 °C до использования.Из-за большого объема гидролиза (15 кг сырья и 15 кг воды) инактивацию протеолитических ферментов проводили не сразу после гидролиза, а путем автоклавирования определенных аликвотных объемов, используемых при приготовлении ферментационных сред.
Эксперименты по выращиванию
Планшеты для микротитрования
Cyberlindnera jadinii LYCC 7549, Thermosacc ® Dry ( Saccharomyces cerevisiae ) (Lallemand Yeast Culture Collection,anomalus CBS100487 (коллекция штаммов Шведского университета сельскохозяйственных наук, Уппсала, Швеция, внутренний номер штамма J121) и B. adeninivorans LS3 (Шведский университет сельскохозяйственных наук, Уппсала, Швеция) хранили в криопробирках, содержащих 20% v/v) глицерин при - 80 °C. Были испытаны на рост десять различных сред: азотная основа для дрожжей без аминокислот и с сульфатом аммония плюс глюкоза (YNBAS + G), азотная основа для дрожжей без аминокислот и с сульфатом аммония плюс гидролизат BALI™ (YNBAS + B), азотная основа для дрожжей без аминокислоты и с мочевиной плюс гидролизат BALI™ (YNBU + B), дрожжевой экстракт и мясной пептон плюс глюкоза (YP + G), дрожжевой экстракт и мясной пептон плюс гидролизат BALI™ (YP + B), гидролизат куриных побочных продуктов плюс глюкоза (CH + G), гидролизат куриных побочных продуктов плюс гидролизат BALI™ (CH + B), гидролизат куриных побочных продуктов (CH) и гидролизат BALI™ (B). Содержание азота (5,86 г/л; исходя из содержания азота в YP, содержащем 20 г/л дрожжевого экстракта и 30 г/л мясного пептона, по данным Кьельдаля) и предполагаемое содержание глюкозы (50 г/л) были одинаковыми в все среды, кроме контрольных сред, содержащих только сахар (В) или только белок (СН). Обратите внимание, что гидролизат BALI содержит дополнительные 16 г/л углеводов на 50 г глюкозы (дополнительный файл 1: таблица S1). Все компоненты среды по отдельности стерилизовали автоклавированием при 121 °C в течение 20 мин, а затем смешивали для получения сред с желаемыми составами.Ночные прекультуры готовили путем добавления 200 мкл посевной культуры к 25 мл тестируемой среды в колбе с перегородкой на 250 мл с последующей инкубацией при 30 °C, 220 об/мин в течение прибл. 16 ч.
Содержание азота (5,86 г/л; исходя из содержания азота в YP, содержащем 20 г/л дрожжевого экстракта и 30 г/л мясного пептона, по данным Кьельдаля) и предполагаемое содержание глюкозы (50 г/л) были одинаковыми в все среды, кроме контрольных сред, содержащих только сахар (В) или только белок (СН). Обратите внимание, что гидролизат BALI содержит дополнительные 16 г/л углеводов на 50 г глюкозы (дополнительный файл 1: таблица S1). Все компоненты среды по отдельности стерилизовали автоклавированием при 121 °C в течение 20 мин, а затем смешивали для получения сред с желаемыми составами.Ночные прекультуры готовили путем добавления 200 мкл посевной культуры к 25 мл тестируемой среды в колбе с перегородкой на 250 мл с последующей инкубацией при 30 °C, 220 об/мин в течение прибл. 16 ч.
Четыре штамма дрожжей выращивали в системе микротитровальных планшетов Duetz (Duetz-MTPS) (Enzyscreen, Heemstede, Нидерланды), состоящей из 24-квадратных полипропиленовых планшетов с глубокими лунками (11 мл), многослойных крышек и зажимов для крышек, которые помещали в шейкер (Infors HT Shaker Minitron, Bottmingen, Швейцария). Автоклавированные и высушенные планшеты для микротитрования заполняли 2,5 мл стерильной жидкой среды. Начальный рН доводили до 5,0 с помощью 1 М NaOH или HCl. Среды инокулировали ночными прекультурами для получения исходной оптической плотности 0,5, измеренной при 595 нм с помощью спектрофотометра UV/VIS (Hitachi U1900, Токио, Япония). Планшеты инкубировали при 30 °C при 450 об/мин и через 8, 16 и 24 часа брали образцы для измерения сухой массы клеток (CDW), свободного амино-азота и рН. Обратите внимание, что эксперименты были организованы с использованием нескольких лунок для каждого условия и что образцы из каждой лунки брались только один раз для измерения сухой массы клеток (CDW), азота свободных аминов и рН.Эти эксперименты проводились в трехкратной повторности.
Автоклавированные и высушенные планшеты для микротитрования заполняли 2,5 мл стерильной жидкой среды. Начальный рН доводили до 5,0 с помощью 1 М NaOH или HCl. Среды инокулировали ночными прекультурами для получения исходной оптической плотности 0,5, измеренной при 595 нм с помощью спектрофотометра UV/VIS (Hitachi U1900, Токио, Япония). Планшеты инкубировали при 30 °C при 450 об/мин и через 8, 16 и 24 часа брали образцы для измерения сухой массы клеток (CDW), свободного амино-азота и рН. Обратите внимание, что эксперименты были организованы с использованием нескольких лунок для каждого условия и что образцы из каждой лунки брались только один раз для измерения сухой массы клеток (CDW), азота свободных аминов и рН.Эти эксперименты проводились в трехкратной повторности.
Периодическая ферментация
Культивирование в биореакторе проводили в стеклянных ферментерах общим объемом 2,5 л (Minifors, Infors, Bottmingen, Швейцария) с рабочим объемом 1,5 л и оборудованных двумя 6-лопастными импеллерами Раштона с использованием YP + G (т. е. 30 г/л мясного пептона, 20 г/л дрожжевого экстракта и 50 г/л глюкозы) и CH + B (т.е. среда «курица»+ ель). YP или CH автоклавировали при 121 °C в течение 15 мин в биореакторах. Глюкозу и гидролизат BALI™ автоклавировали отдельно.Ночные прекультуры готовили путем добавления 1 мл посевной культуры [80 % (об./об.) ночной культуры на стандартном YPD (Sigma-Aldrich, Миссури, США), 20 % (об./об.) глицерина, хранившейся при − 80 °C] в 250 мл среды YP + G или CH + B в 2-литровых шейкерных колбах с перегородками с последующей инкубацией при 30 °C, 220 об/мин в течение прибл. 16 ч. В биореакторы инокулировали 30 мл прекультуры в течение ночи (2% (об./об.)), и каждую ферментацию проводили дважды. Температура для всех культиваций составляла 30 °C. рН контролировали с помощью рН-зонда (Mettler Toledo, Грайфензее, Швейцария). ) и остался на уровне 5.0 путем автоматического добавления 1 М NaOH или 5 М H 2 SO 4 . DO поддерживали на уровне примерно 30% насыщения (± 5%) и регулировали вручную скоростью мешалки (300–1250 об/мин).
е. 30 г/л мясного пептона, 20 г/л дрожжевого экстракта и 50 г/л глюкозы) и CH + B (т.е. среда «курица»+ ель). YP или CH автоклавировали при 121 °C в течение 15 мин в биореакторах. Глюкозу и гидролизат BALI™ автоклавировали отдельно.Ночные прекультуры готовили путем добавления 1 мл посевной культуры [80 % (об./об.) ночной культуры на стандартном YPD (Sigma-Aldrich, Миссури, США), 20 % (об./об.) глицерина, хранившейся при − 80 °C] в 250 мл среды YP + G или CH + B в 2-литровых шейкерных колбах с перегородками с последующей инкубацией при 30 °C, 220 об/мин в течение прибл. 16 ч. В биореакторы инокулировали 30 мл прекультуры в течение ночи (2% (об./об.)), и каждую ферментацию проводили дважды. Температура для всех культиваций составляла 30 °C. рН контролировали с помощью рН-зонда (Mettler Toledo, Грайфензее, Швейцария). ) и остался на уровне 5.0 путем автоматического добавления 1 М NaOH или 5 М H 2 SO 4 . DO поддерживали на уровне примерно 30% насыщения (± 5%) и регулировали вручную скоростью мешалки (300–1250 об/мин). Культуры аэрировали через барботер с начальной скоростью 1,5 л/мин (1 VVM), которую увеличивали до 3 л/мин (2 VVM) во время ферментации для поддержания DO. Анализ выхлопных газов CO 2 и O 2 выполняли с помощью анализатора отходящих газов FerMac 368 (Electrolab Biotech, Тьюксбери, Великобритания).Пену контролировали с помощью датчика пены с пятикратно разбавленным пеногасителем Glanapon DB 870 (Busetti, Вена, Австрия). Данные о ферментации регистрировали с использованием программного обеспечения IRIS для управления процессом (Infors). Во время ферментации образцы асептически отбирали каждые два часа для анализа супернатанта культуры и биомассы дрожжей.
Культуры аэрировали через барботер с начальной скоростью 1,5 л/мин (1 VVM), которую увеличивали до 3 л/мин (2 VVM) во время ферментации для поддержания DO. Анализ выхлопных газов CO 2 и O 2 выполняли с помощью анализатора отходящих газов FerMac 368 (Electrolab Biotech, Тьюксбери, Великобритания).Пену контролировали с помощью датчика пены с пятикратно разбавленным пеногасителем Glanapon DB 870 (Busetti, Вена, Австрия). Данные о ферментации регистрировали с использованием программного обеспечения IRIS для управления процессом (Infors). Во время ферментации образцы асептически отбирали каждые два часа для анализа супернатанта культуры и биомассы дрожжей.
Аналитические методы
Сухая масса клеток (CDW)
Образцы ферментационного бульона (25 мл из биореакторов и 2 мл из микропланшетов) центрифугировали при 4700 g (25 мл) или 10 000 g (2 мл) в течение 5 мин при 4° C и супернатант собирали для дальнейших анализов (сахара, органические кислоты, этанол, свободный амино-азот, белок). Затем дрожжевые клетки дважды промывали холодной дистиллированной водой, замораживали при - 20 C, а затем лиофилизировали с использованием Alpha 2–4 LDplus (Martin Christ, Osterode am Harz, Германия) при - 60 °C и вакууме 0,01 мбар. на 48 ч. После определения их массы для расчета КДВ высушенные клетки использовали для анализа содержания белка, аминокислот, нуклеиновых кислот, липидов, волокон, минералов и золы, а также анализировали методом ИК-Фурье-спектроскопии.
Затем дрожжевые клетки дважды промывали холодной дистиллированной водой, замораживали при - 20 C, а затем лиофилизировали с использованием Alpha 2–4 LDplus (Martin Christ, Osterode am Harz, Германия) при - 60 °C и вакууме 0,01 мбар. на 48 ч. После определения их массы для расчета КДВ высушенные клетки использовали для анализа содержания белка, аминокислот, нуклеиновых кислот, липидов, волокон, минералов и золы, а также анализировали методом ИК-Фурье-спектроскопии.
Моносахариды, органические кислоты и этанол
Моносахариды (d-глюкоза, d-ксилоза), органические кислоты (молочная кислота, уксусная кислота) и этанол, присутствующие в ферментационном бульоне, анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с показателем преломления обнаружение.Образцы разбавляли в 10 раз дистиллированной водой и 200 мкл фильтровали под вакуумом через 96-луночные фильтровальные планшеты (0,45 мкм). Образцы разделяли на аналитической колонке Rezex ROA-organic acid H+, 300 × 7,8 мм 2 (Phenomenex, Торранс, Калифорния, США), снабженной защитной колонкой с картриджем катион-H, при температуре колонки 65 °C, 5 мМ H 2 SO 4 в качестве элюента и скорость потока 0,6 мл/мин. Кроме того, моносахариды анализировали с помощью высокоэффективной анионообменной хроматографии (HPAEC) с использованием системы Dionex ICS 3000 (Dionex, Саннивейл, Калифорния, США), оснащенной колонкой CarboPac PA1, работающей при 30 °C, и с импульсным амперометрическим детектированием (PAD). ), где можно количественно определить d-ксилозу, L-арабинозу, d-маннозу и d-галактозу.Моносахариды элюировали изократически со скоростью потока 0,25 мл/мин, используя 1 мМ КОН, полученный с помощью генератора элюента. Данные ВЭЖХ собирали и анализировали с использованием Chromeleon 7.0.
Кроме того, моносахариды анализировали с помощью высокоэффективной анионообменной хроматографии (HPAEC) с использованием системы Dionex ICS 3000 (Dionex, Саннивейл, Калифорния, США), оснащенной колонкой CarboPac PA1, работающей при 30 °C, и с импульсным амперометрическим детектированием (PAD). ), где можно количественно определить d-ксилозу, L-арабинозу, d-маннозу и d-галактозу.Моносахариды элюировали изократически со скоростью потока 0,25 мл/мин, используя 1 мМ КОН, полученный с помощью генератора элюента. Данные ВЭЖХ собирали и анализировали с использованием Chromeleon 7.0.
Свободный амино-азот
Анализ на основе нингидрина был проведен для отслеживания потребления свободного амино-азота во время ферментации [21]. Нингидрин реагирует со свободными альфа-аминогруппами, в результате чего образуется продукт синего цвета, который можно количественно определить колориметрически, измерив оптическую плотность при 575 нм.Глицин использовали для получения стандартной кривой с известным содержанием свободного аминного азота (0,04–0,4 г/л азота). 10 мкл (при необходимости разбавленных) образцов добавляли к 100 мкл нингидринового реагента, забуференного ацетатом с pH 5,5 (содержащего 25 мкл/мл SnCl 2 ), смешивали и инкубировали при 100 °C в течение 10 мин. Анализ проводили в формате микропланшетов (два повтора), а оптическую плотность измеряли с помощью гибридного многорежимного считывателя микропланшетов Synergy h5 (BioTek, Winooski, Вермонт, США)
10 мкл (при необходимости разбавленных) образцов добавляли к 100 мкл нингидринового реагента, забуференного ацетатом с pH 5,5 (содержащего 25 мкл/мл SnCl 2 ), смешивали и инкубировали при 100 °C в течение 10 мин. Анализ проводили в формате микропланшетов (два повтора), а оптическую плотность измеряли с помощью гибридного многорежимного считывателя микропланшетов Synergy h5 (BioTek, Winooski, Вермонт, США)
Содержание белка
Общий азот измеряли по методу Кьельдаля ( Регламент Европейской комиссии [ЕС] №: 152/2009, стр. 15–19) с использованием Kjeltec TM 8400 (FOSS, Tecator, Höganäs, Швеция) после кислотного разложения в автодигесторе (FOSS, Tecator, Höganas, Швеция).Содержание белка в образцах оценивали путем умножения общего азота на коэффициент 6,25.
Аминокислоты
Анализ содержания аминокислот (кроме триптофана) в сублимированных дрожжах проводили в соответствии с Регламентом ЕС № 152/2009 (стр. 23–32) с использованием анализатора аминокислот «Биохром 30» (Biochrom Ltd. ). ., Кембридж, Великобритания). Триптофан анализировали в соответствии с постановлением ЕС № 152/2009 (стр. 32–37) с использованием системы ВЭЖХ Dionex Ultimate 3000 (Dionex Softron GmbH, Гермеринг, Германия), соединенной с флуоресцентным детектором RF-535 (Shimadzu., Киото, Япония). Все аминокислоты были количественно определены с использованием внешних стандартов (Dionex Ltd., Суррей, Великобритания).
). ., Кембридж, Великобритания). Триптофан анализировали в соответствии с постановлением ЕС № 152/2009 (стр. 32–37) с использованием системы ВЭЖХ Dionex Ultimate 3000 (Dionex Softron GmbH, Гермеринг, Германия), соединенной с флуоресцентным детектором RF-535 (Shimadzu., Киото, Япония). Все аминокислоты были количественно определены с использованием внешних стандартов (Dionex Ltd., Суррей, Великобритания).
Нуклеиновые кислоты
Содержание нуклеиновых кислот в биомассе дрожжей определяли спектрофотометрически с помощью анализа дифениламина (ДНК) и анализа орцинола (РНК) после экстракции разбавленной хлорной кислотой [22]. Перед экстракцией 50 мг лиофилизированных дрожжевых клеток промывали 1,5 мл 0,9% солевого раствора (холод), а затем 1,5 мл 0,2 М HClO 4 (холод). Впоследствии 1.Добавляли 5 мл 0,5 М HClO 4 , клетки инкубировали при 70 °C в течение 15 минут, центрифугировали и сохраняли супернатант. К клеткам добавляли еще 1,5 мл 0,5 М HClO 4 с последующим перемешиванием, повторной инкубацией при 70 °C в течение 15 мин и центрифугированием. Супернатанты объединяли и разбавляли до 5,0 мл 0,5 М HClO 4 . Экстракты HClO 4 из клеток дрожжей и стандарты ДНК (ДНК тимуса теленка; Sigma D4522) смешивали с дифениламиновым реагентом 1:1 (об:об) (исходный раствор 1.5 г дифениламина, 100 мл ледяной уксусной кислоты, 1,5 мл концентрированной серной кислоты и 1 мл раствора ацетальдегида) в 96-луночных планшетах, инкубировали при 30 °C в течение ночи, и считывали оптическую плотность при 600 нм на ридере для микропланшетов Spectramax M2 e . (Molecular Devices, LLC, Сан-Хосе, Калифорния, США). HClO 4 -экстракты дрожжевых клеток и стандарты РНК (РНК пекарских дрожжей; Sigma R6750) смешивали с раствором H 2 SO 4 /H 2 O (об./об.; 85/15) в 96-луночных планшетах и инкубировали при 40°C в течение 24 часов.Затем добавляли реагент орцин (исходный раствор 0,35 мл 6% (масса/объем) орцинола в 5 мл концентрированной HCl) и планшеты инкубировали при осторожном встряхивании при 100 °C в течение 30 мин, после чего определяли поглощение при 500 нм.
Супернатанты объединяли и разбавляли до 5,0 мл 0,5 М HClO 4 . Экстракты HClO 4 из клеток дрожжей и стандарты ДНК (ДНК тимуса теленка; Sigma D4522) смешивали с дифениламиновым реагентом 1:1 (об:об) (исходный раствор 1.5 г дифениламина, 100 мл ледяной уксусной кислоты, 1,5 мл концентрированной серной кислоты и 1 мл раствора ацетальдегида) в 96-луночных планшетах, инкубировали при 30 °C в течение ночи, и считывали оптическую плотность при 600 нм на ридере для микропланшетов Spectramax M2 e . (Molecular Devices, LLC, Сан-Хосе, Калифорния, США). HClO 4 -экстракты дрожжевых клеток и стандарты РНК (РНК пекарских дрожжей; Sigma R6750) смешивали с раствором H 2 SO 4 /H 2 O (об./об.; 85/15) в 96-луночных планшетах и инкубировали при 40°C в течение 24 часов.Затем добавляли реагент орцин (исходный раствор 0,35 мл 6% (масса/объем) орцинола в 5 мл концентрированной HCl) и планшеты инкубировали при осторожном встряхивании при 100 °C в течение 30 мин, после чего определяли поглощение при 500 нм. считывайте на планшет-ридере Spectramax M2 e (Molecular Devices).
считывайте на планшет-ридере Spectramax M2 e (Molecular Devices).
Липиды
Общее содержание липидов в лиофилизированной биомассе дрожжей определяли с помощью ускоренной экстракции растворителем [23]. Экстракцию проводили при 125 °C и 1500 фунтов на кв. дюйм смесью 70 % петролейного эфира — 30 % ацетона в экстракторе Dionex ASE 350 для ускоренного растворителя (Dionex, Саннивейл, Калифорния, США).Затем растворитель помещали в стакан для сбора, который погружали в водяную баню при 60°C для выпаривания под давлением N 2 . Через 10 мин в стакане для сбора остались только липиды, и их поместили в вакуумную сушилку при 70 °С на 30 мин. Наконец, образцы помещали в эксикатор и взвешивали липиды.
Минералы и зола
Содержание минералов в биомассе лиофилизированных дрожжей анализировали с помощью масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС) (Agilent 8800 QQQ, Санта-Клара, Калифорния, США).Образцы разлагали 65% HNO 3 в высокопроизводительном микроволновом реакторе (UltraClave, MLS, Milestone, Sorisole, Италия) [24]. Для галогенидов (анионов) образцы разлагали с использованием концентрированного 25% (вес/вес) гидроксида тетраметиламмония. Минеральные анализы были подтверждены с использованием сертифицированных эталонных материалов NCS DC73349 (Национальный центр анализа железа и стали, Пекин, Китай) и CRM GBW07603 (Национальный исследовательский центр CRM, Пекин, Китай). Зольность биомассы лиофилизированных дрожжей определяли в соответствии с техническим отчетом NREL/TP-510-42622 Национальной лаборатории возобновляемых источников энергии [25].
Для галогенидов (анионов) образцы разлагали с использованием концентрированного 25% (вес/вес) гидроксида тетраметиламмония. Минеральные анализы были подтверждены с использованием сертифицированных эталонных материалов NCS DC73349 (Национальный центр анализа железа и стали, Пекин, Китай) и CRM GBW07603 (Национальный исследовательский центр CRM, Пекин, Китай). Зольность биомассы лиофилизированных дрожжей определяли в соответствии с техническим отчетом NREL/TP-510-42622 Национальной лаборатории возобновляемых источников энергии [25].
Инфракрасная Фурье-спектроскопия (FTIR)
FTIR-анализ биомассы лиофилизированных дрожжей выполняли с помощью FTIR-спектрометра Agilent серии 5500 (Agilent, Санта-Клара, США) с использованием алмазного кристалла типа IIA с одинарным отражением и ослабленным полным коэффициентом отражения (ATR). ) аксессуар с образцом пресса. Приблизительно 10 мг образцов лиофилизированных дрожжей измеряли в спектральном диапазоне 4000–650 см -1 с разрешением 8 см -1 и 32 сканированиями. Фоновые спектры (пустой кристалл) измеряли перед каждым образцом и использовали для коррекции.Алмазный кристалл аксессуара ATR (Attenuated Total Reflection) очищали 70% изопропанолом и дистиллированной водой после каждого измерения. Полученные необработанные спектры подвергались EMSC (расширенной мультипликативной коррекции сигнала) [26]. Обработку спектров проводили с помощью The Unscramble X 10.5 (CAMO Software, Осло, Норвегия).
Фоновые спектры (пустой кристалл) измеряли перед каждым образцом и использовали для коррекции.Алмазный кристалл аксессуара ATR (Attenuated Total Reflection) очищали 70% изопропанолом и дистиллированной водой после каждого измерения. Полученные необработанные спектры подвергались EMSC (расширенной мультипликативной коррекции сигнала) [26]. Обработку спектров проводили с помощью The Unscramble X 10.5 (CAMO Software, Осло, Норвегия).
Статистический анализ
Эксперименты по выращиванию в Duetz-MTPS и в ферментерах объемом 2,5 л проводились соответственно в трех и двух повторностях.Представленные результаты представляют собой среднее значение повторов, а стандартные отклонения показаны в виде планок погрешностей на рисунках. Обработку данных и статистику проводили с использованием программного пакета Excel (Microsoft Excel 2013, Microsoft Corp., Редмонд, Вашингтон). ANOVA (α = 0,05) использовали для анализа различий в аминокислотном составе с использованием JPM v.14.1 (SAS, Кэри, Северная Каролина, США) и сравнения всех пар с использованием Tukey-Kramer HSD (честная значительная разница). Анализ основных компонентов (PCA) был выполнен с использованием The Unscrambler X, V10.5 (КАМО, Осло, Норвегия).
Анализ основных компонентов (PCA) был выполнен с использованием The Unscrambler X, V10.5 (КАМО, Осло, Норвегия).
Улучшенное производство ванилина из пекарских дрожжей благодаря дизайну in silico | Microbial Cell Factory
Ванилин Производство β-D-глюкозидов в
S. cerevisiae Ванилин токсичен для многих живых организмов. В случае S. cerevisiae дефект роста значителен при таких низких концентрациях, как 0,5 г/л [5]. Таким образом, решение проблемы токсичности ванилина является важной предпосылкой для создания экономически жизнеспособного завода по производству ванилиновых клеток.Элегантным решением является гликозилирование ванилина, наблюдаемое у природного продуцента Vanilla planifolia [25, 26]. Эта стратегия была успешно реализована Hansen et al. (2002) в Schizosaccharmyces pombe [5]. Стадия гликозилирования подразумевает снижение максимального теоретического выхода с 0,57 ммоль Van /моль glc до 0,35 ммоль Van /моль glc . По массе максимально достижимый выход 486 мг van /г glc меняется на относительно скромные 293 мг Van /г glc .Тем не менее, учитывая токсичность и низкую растворимость ванилина, достижение высоких титров не является благоприятным вариантом. Было показано, что в случае β-D-глюкозида ванилина (или VG) внеклеточная концентрация до 25 г/л не влияет на рост и, таким образом, более подходит для коммерческого производства.
По массе максимально достижимый выход 486 мг van /г glc меняется на относительно скромные 293 мг Van /г glc .Тем не менее, учитывая токсичность и низкую растворимость ванилина, достижение высоких титров не является благоприятным вариантом. Было показано, что в случае β-D-глюкозида ванилина (или VG) внеклеточная концентрация до 25 г/л не влияет на рост и, таким образом, более подходит для коммерческого производства.
В S. pombe гетерологичная экспрессия гена, кодирующего растительную гликозилтрансферазу семейства 1 из Arabidopsis thaliana ( UGT72E2) , привела к 80% превращению ванилина в ванилин β-D-глюкозид [5].В рамках этого исследования UGT72E2 экспрессировался в продуцирующем ванилин штамме S. cerevisiae VAN286, полученном от Hansen et al. . [5]. Полученный штамм VG0 выращивали на минимальной среде, содержащей 20 г/л глюкозы, в течение 90 часов. В этот момент культуру собирали и внеклеточный бульон анализировали на наличие ванилина и VG.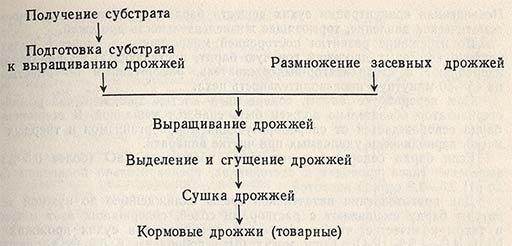 VG значительно накапливался в бульоне (>100 мг/л), в то время как ванилин был едва обнаружен (<7 мг/л), что свидетельствует об эффективном превращении ванилина в VG.
VG значительно накапливался в бульоне (>100 мг/л), в то время как ванилин был едва обнаружен (<7 мг/л), что свидетельствует об эффективном превращении ванилина в VG.
Существование большого количества альтернативных путей потока (путей) в метаболических моделях масштаба генома требует использования экспериментальных ограничений для получения физиологически значимых распределений потоков. Это еще более важно в случае MOMA, где предсказания распределения потока мутантов будут сильно зависеть от решения, предоставленного для распределения потока дикого типа (или эталонного) [24]. Таким образом, формулировка модели должна быть способна учитывать основные метаболические физиологические характеристики рассматриваемых штаммов.В частности, при выращивании с ферментируемым источником углерода S. cerevisiae обладает способностью расти в отсутствие кислорода, производя этанол в качестве основного побочного продукта. В присутствии кислорода происходит дыхание, но если концентрация и/или скорость поглощения глюкозы превышают критическое пороговое значение, метаболизм становится сочетанием дыхания и спиртового брожения [27, 28].
Эталонные метаболические состояния
Различные метаболические состояния S. cerevisiae характеризуются разной скоростью поглощения питательных веществ, разной скоростью производства метаболитов и разным выходом биомассы.Следовательно, важно решить, какие метаболические состояния следует использовать для ограничения метаболической модели, чтобы получить надежные целевые прогнозы для генетических манипуляций с целью повышения продуктивности. Кроме того, следует ожидать, что разные ограничения (соответствующие разным метаболическим состояниям) могут привести к разным предположениям в отношении целей метаболической инженерии. Чтобы решить эту проблему, мы использовали три разных сценария для получения эталонного распределения потока для моделирования MOMA.Ссылка 1 представляла собой исключительно респираторный метаболизм, характеризующийся отсутствием образования этанола и низкой скоростью поглощения глюкозы. Эталон 2 был смоделирован для респираторно-ферментативного метаболизма, характеризующегося высокими скоростями поглощения глюкозы, спиртовым брожением и активным дыханием. Поскольку оба распределения потоков были получены с использованием FBA для максимального увеличения производства биомассы, не прогнозировалось накопление VG или родственных соединений. Третье моделирование FBA было выполнено для получения распределения потока для VG0 (ссылка 3).Модель была ограничена с использованием данных, полученных в этом исследовании при культивировании хемостата при скорости разбавления 0,1 ч -1 . При такой степени разбавления наблюдался высокоферментативный метаболизм, что указывало на ограниченную дыхательную способность штамма. Вместе три различных эталонных распределения потоков охватывают все соответствующие стили жизни S. cerevisiae и, следовательно, могут использоваться для определения потенциальных целей для генетических манипуляций с использованием моделирующей среды OptGene. Поскольку подходы к установившемуся состоянию не могут предсказать изменения скорости поглощения субстрата и, следовательно, продуктивности мутантов, Patil et al .
Поскольку оба распределения потоков были получены с использованием FBA для максимального увеличения производства биомассы, не прогнозировалось накопление VG или родственных соединений. Третье моделирование FBA было выполнено для получения распределения потока для VG0 (ссылка 3).Модель была ограничена с использованием данных, полученных в этом исследовании при культивировании хемостата при скорости разбавления 0,1 ч -1 . При такой степени разбавления наблюдался высокоферментативный метаболизм, что указывало на ограниченную дыхательную способность штамма. Вместе три различных эталонных распределения потоков охватывают все соответствующие стили жизни S. cerevisiae и, следовательно, могут использоваться для определения потенциальных целей для генетических манипуляций с использованием моделирующей среды OptGene. Поскольку подходы к установившемуся состоянию не могут предсказать изменения скорости поглощения субстрата и, следовательно, продуктивности мутантов, Patil et al . (2005) предложили использовать выход продукции биомассы в сочетании с целью проектирования. BPCY определяется как произведение выхода продукта и потока биомассы [16].
(2005) предложили использовать выход продукции биомассы в сочетании с целью проектирования. BPCY определяется как произведение выхода продукта и потока биомассы [16].
Оценка предсказаний in silico
Моделирование было выполнено с использованием OptGene [16] для предсказания до шести целей нокаута реакции. Улучшение производства VG не было предсказано при использовании максимизации производства биомассы в качестве биологической цели, в то время как использование MOMA [24] предложило интересные цели даже после удаления одной реакции.Цели, предложенные OptGene, были проверены на оптимальность с помощью OptKnock [15]. Среди множества возможных целевых реакций (рис. 2А) биомасса и выход VG обычно связаны с обратной тенденцией, поэтому, когда прогнозируемый выход биомассы высок, прогнозируемый выход продукта имеет тенденцию быть скромным, и наоборот. Целевой выбор для экспериментальной проверки должен обеспечить хороший баланс между улучшенным производством VG и разумным прогнозом выхода биомассы (рис. 2A). Метаболическая адаптация (согласно определению Segre et al., 2002 [24]) использовался в качестве дополнительного фактора для ранжирования каждого из целевых наборов-кандидатов. Вкратце, метаболическая адаптация мутанта определяется как евклидово расстояние между эталонным и мутантным векторами распределения потока. Наша гипотеза состоит в том, что меньшие метаболические корректировки с большей вероятностью будут достигнуты 90–181 in vivo 90–182, чем большие корректировки. Это было принято во внимание путем введения новой метрики для ранжирования in silico предсказанных мутантов, , а именно. , отношение вознаграждения к риску (R 3 ), определяемое как соотношение между BPCY (вознаграждение) и метаболической адаптацией (риск).Наиболее интересные мишени, полученные после ранжирования каждого прогноза в соответствии со счетом R 3 , представлены на рисунке 2 (B, C и D).
2A). Метаболическая адаптация (согласно определению Segre et al., 2002 [24]) использовался в качестве дополнительного фактора для ранжирования каждого из целевых наборов-кандидатов. Вкратце, метаболическая адаптация мутанта определяется как евклидово расстояние между эталонным и мутантным векторами распределения потока. Наша гипотеза состоит в том, что меньшие метаболические корректировки с большей вероятностью будут достигнуты 90–181 in vivo 90–182, чем большие корректировки. Это было принято во внимание путем введения новой метрики для ранжирования in silico предсказанных мутантов, , а именно. , отношение вознаграждения к риску (R 3 ), определяемое как соотношение между BPCY (вознаграждение) и метаболической адаптацией (риск).Наиболее интересные мишени, полученные после ранжирования каждого прогноза в соответствии со счетом R 3 , представлены на рисунке 2 (B, C и D).
Сравнение целей, предсказанных OptGene для повышения производительности VG . A — Биомасса по сравнению с выходом VG представлена для каждого нокаутного мутантного фенотипа, полученного после моделирования OptGene с использованием трех различных эталонных распределений потоков для MOMA. Экспериментальные выходы, наблюдаемые для VG0, представлены красным пустым треугольником и полосой. B/C/D — Прогнозируемый выход VG (моль/моль glc ), полученный для каждого нокаутного мутанта после моделирования OptGene с использованием эталона 1/2/3, представлен длиной цветных полос. Для каждого эталонного распределения потока оценивали показатель R 3 для каждого из мутантов, который рассчитывали и нормализовали к мутанту, представляющему наибольшее значение: MA mut /MA max *100. 100% представляет мутант с наивысшим баллом R 3 для данного распределения потока.Кандидат 80% PDC не является нокаутом in silico мутанта , скорее его реакция PDC ограничена 80% верхней границы.
A — Биомасса по сравнению с выходом VG представлена для каждого нокаутного мутантного фенотипа, полученного после моделирования OptGene с использованием трех различных эталонных распределений потоков для MOMA. Экспериментальные выходы, наблюдаемые для VG0, представлены красным пустым треугольником и полосой. B/C/D — Прогнозируемый выход VG (моль/моль glc ), полученный для каждого нокаутного мутанта после моделирования OptGene с использованием эталона 1/2/3, представлен длиной цветных полос. Для каждого эталонного распределения потока оценивали показатель R 3 для каждого из мутантов, который рассчитывали и нормализовали к мутанту, представляющему наибольшее значение: MA mut /MA max *100. 100% представляет мутант с наивысшим баллом R 3 для данного распределения потока.Кандидат 80% PDC не является нокаутом in silico мутанта , скорее его реакция PDC ограничена 80% верхней границы.
В зависимости от эталонного распределения потока, используемого в MOMA, для нокаута предлагались разные цели. Некоторые из мишеней, например GDh2, были идентифицированы более чем в одном физиологическом состоянии роста. Однако их позиции в рейтинге R 3 сильно различаются, демонстрируя, что лучшие цели в одном физиологическом сценарии не обязательно являются лучшими целями в другом.Результаты прогностического анализа показывают, что продукция VG предпочтительнее при тех физиологических условиях, которые приводят к респираторно-ферментативному метаболизму, по сравнению с физиологическими состояниями, приводящими исключительно к респираторному метаболизму. Результатом минимальной корректировки метаболизма является перенаправление потока этанола на образование VG, а не отвлечение потока от компонентов биомассы. Действительно, предполагается, что некоторые из кандидатов, предложенных на рисунке 2, будут иметь более низкое образование этанола, чем эталон.Точно так же выход биомассы, предсказанный для всех предложенных мутантов (с распределением потока VG0 в качестве эталона), немного выше, чем для эталона, опять же за счет образования этанола.
Некоторые из мишеней, например GDh2, были идентифицированы более чем в одном физиологическом состоянии роста. Однако их позиции в рейтинге R 3 сильно различаются, демонстрируя, что лучшие цели в одном физиологическом сценарии не обязательно являются лучшими целями в другом.Результаты прогностического анализа показывают, что продукция VG предпочтительнее при тех физиологических условиях, которые приводят к респираторно-ферментативному метаболизму, по сравнению с физиологическими состояниями, приводящими исключительно к респираторному метаболизму. Результатом минимальной корректировки метаболизма является перенаправление потока этанола на образование VG, а не отвлечение потока от компонентов биомассы. Действительно, предполагается, что некоторые из кандидатов, предложенных на рисунке 2, будут иметь более низкое образование этанола, чем эталон.Точно так же выход биомассы, предсказанный для всех предложенных мутантов (с распределением потока VG0 в качестве эталона), немного выше, чем для эталона, опять же за счет образования этанола. Среди целей, изображенных на рисунке 2, пируват, по-видимому, охватывает соответствующее стехиометрическое узкое место, поскольку несколько реакций метаболизма пирувата были предложены в качестве целей для удаления при рассмотрении различных эталонных распределений потоков. Кроме того, были идентифицированы гены, связанные с метаболизмом аммония, пентозофосфатным путем и центральным углеродным метаболизмом в целом.
Среди целей, изображенных на рисунке 2, пируват, по-видимому, охватывает соответствующее стехиометрическое узкое место, поскольку несколько реакций метаболизма пирувата были предложены в качестве целей для удаления при рассмотрении различных эталонных распределений потоков. Кроме того, были идентифицированы гены, связанные с метаболизмом аммония, пентозофосфатным путем и центральным углеродным метаболизмом в целом.
Выбор мишени
Мишени для реализации in vivo были выбраны путем уделения особого внимания оценке R 3 различных мишеней в различных условиях моделирования в сочетании с ручной оценкой пригодности предполагаемых генных мишеней на основе по имеющимся в литературе данным. Поиск в литературе и базе данных включал возможное существование изоферментов, экспериментально наблюдаемые фенотипы делеции одного гена и оценку важности регуляторных связей с другими процессами [29].На основании этого анализа два гена-кандидата, PDC1 (пируватдекарбоксилаза) и GDh2 (глутаматдегидрогеназа), были выбраны в качестве кандидатов для конструирования и характеристики штамма. Было предсказано, что реакция, катализируемая Gdh2, является основной мишенью для нокаута при использовании дыхательного или респираторно-ферментативного метаболизма, и в обоих случаях была предсказана относительно большая метаболическая адаптация. GDh2 кодирует NADPH-зависимую глутаматдегидрогеназу, участвующую в метаболизме аммония посредством биосинтеза глутамата, который, как сообщается, обеспечивает 85% клеточных источников азота [30].Метаболизм аммония был тщательно изучен у S. cerevisiae , и, в частности, делеция GDh2 ранее использовалась в качестве стратегии метаболической инженерии для улучшения производства этанола и сесквитерпенов [6, 8, 31]. Сообщалось, что сконструированные штаммы имеют повышенный пул НАДФН, кинетическая/термодинамическая особенность, которая не учитывалась в нашей стратегии моделирования. Следовательно, хотя делеция этого гена не предлагалась, когда сеть была ограничена экспериментальными результатами (VG0), мы ожидаем, что делеция этого гена термодинамически благоприятствует превращению PAC в PAL с помощью ACAR.
Было предсказано, что реакция, катализируемая Gdh2, является основной мишенью для нокаута при использовании дыхательного или респираторно-ферментативного метаболизма, и в обоих случаях была предсказана относительно большая метаболическая адаптация. GDh2 кодирует NADPH-зависимую глутаматдегидрогеназу, участвующую в метаболизме аммония посредством биосинтеза глутамата, который, как сообщается, обеспечивает 85% клеточных источников азота [30].Метаболизм аммония был тщательно изучен у S. cerevisiae , и, в частности, делеция GDh2 ранее использовалась в качестве стратегии метаболической инженерии для улучшения производства этанола и сесквитерпенов [6, 8, 31]. Сообщалось, что сконструированные штаммы имеют повышенный пул НАДФН, кинетическая/термодинамическая особенность, которая не учитывалась в нашей стратегии моделирования. Следовательно, хотя делеция этого гена не предлагалась, когда сеть была ограничена экспериментальными результатами (VG0), мы ожидаем, что делеция этого гена термодинамически благоприятствует превращению PAC в PAL с помощью ACAR.
Пируват является ключевым метаболитом в метаболизме S. cerevisiae и точкой ветвления между дыхательным и ферментативным метаболизмом. Пируватдекарбоксилазы (ПДК) имеют решающее значение для ферментации, поскольку эта реакция декарбоксилирования превращает пируват в ацетальдегид, промежуточный продукт образования этанола [32]. Геном S. cerevisiae содержит три структурных гена PDC ( PDC1, 5 и 6 ), один регуляторный ген ( PDC2 ) и два других гена с потенциальным вкладом в активность PDC ( PDC3 и 4 4) ) [32, 33].Полное подавление активности пируватдекарбоксилазы ( pdc1 Δ, pdc5Δ и pdc6Δ ) создает мутант, который не может расти на глюкозе как на единственном источнике углерода [33, 34]. При анализе in silico было обнаружено, что PDC является мишенью для увеличения образования VG с учетом как респираторных, так и респираторно-ферментативных эталонных потоков для MOMA, но не тогда, когда данные VG0 использовались для ограничения сети. Кроме того, было предсказано, что полное отсутствие активности пируватдекарбоксилазы в условиях сильного брожения приведет к нулевому росту, поскольку отсутствие активности PDC потребует очень значительной метаболической корректировки.Это наблюдение в сочетании с имеющимися в литературе экспериментальными данными для мутанта без активности PDC [33, 34] поднимает интересный вопрос — каков будет эффект лишь частичного снижения активности PDC, т.е. делецией одного из структурных генов? Чтобы смоделировать эту ситуацию, поток PDC был ограничен до 80% потока, наблюдаемого в эталонном штамме. Это моделирование предсказало положительный рост, а также более высокое производство VG по сравнению с другими целями, такими как GDh2 (рис. 2).Из трех структурных генов PDC PDC1 был выбран в качестве мишени для делеции in vivo , поскольку есть экспериментальные данные о том, что его удаление приводит к ~30% снижению общей активности пируватдекарбоксилазы [34].
Кроме того, было предсказано, что полное отсутствие активности пируватдекарбоксилазы в условиях сильного брожения приведет к нулевому росту, поскольку отсутствие активности PDC потребует очень значительной метаболической корректировки.Это наблюдение в сочетании с имеющимися в литературе экспериментальными данными для мутанта без активности PDC [33, 34] поднимает интересный вопрос — каков будет эффект лишь частичного снижения активности PDC, т.е. делецией одного из структурных генов? Чтобы смоделировать эту ситуацию, поток PDC был ограничен до 80% потока, наблюдаемого в эталонном штамме. Это моделирование предсказало положительный рост, а также более высокое производство VG по сравнению с другими целями, такими как GDh2 (рис. 2).Из трех структурных генов PDC PDC1 был выбран в качестве мишени для делеции in vivo , поскольку есть экспериментальные данные о том, что его удаление приводит к ~30% снижению общей активности пируватдекарбоксилазы [34].
Конструирование и характеристика штамма
После отбора двух генов-мишеней были сконструированы два мутанта с делецией одного гена, gdh2 Δ и pdc1 , на фоне VG0, что привело к VG1 и VG2 соответственно. Чтобы проверить, будет ли одновременная делеция PDC1 и GDh2 оказывать положительный синергетический эффект на накопление VG, был получен мутант с обеими делециями (VG3). Первоначально штаммы были охарактеризованы в периодическом культивировании в хорошо контролируемых биореакторах объемом 2 л с использованием минимальной среды и начальной концентрации глюкозы 20 г/л (таблица 1). Мутант VG2 ( pdc1Δ ) продемонстрировал общую повышенную приспособленность по сравнению с эталонным штаммом, о чем свидетельствует более высокая максимальная удельная скорость роста на 43% (μ макс , (ч -1 ) α время удвоения -1 ). по сравнению с VG0.Точно так же выход биомассы на глюкозе (Y S X , г DW /г) на 40% выше, чем наблюдаемый для VG0. С другой стороны, мутант VG1 ( gdh2 Δ) показал пониженную приспособленность штамма, что иллюстрируется плохим μ max и сниженным Y S X . Эти неблагоприятные эффекты на приспособленность VG1 были частично устранены делецией PDC1 , о чем свидетельствуют несколько улучшенные значения μ max и Y S X для штамма VG3 ( pdc1Δgdh2Δ ).
Чтобы проверить, будет ли одновременная делеция PDC1 и GDh2 оказывать положительный синергетический эффект на накопление VG, был получен мутант с обеими делециями (VG3). Первоначально штаммы были охарактеризованы в периодическом культивировании в хорошо контролируемых биореакторах объемом 2 л с использованием минимальной среды и начальной концентрации глюкозы 20 г/л (таблица 1). Мутант VG2 ( pdc1Δ ) продемонстрировал общую повышенную приспособленность по сравнению с эталонным штаммом, о чем свидетельствует более высокая максимальная удельная скорость роста на 43% (μ макс , (ч -1 ) α время удвоения -1 ). по сравнению с VG0.Точно так же выход биомассы на глюкозе (Y S X , г DW /г) на 40% выше, чем наблюдаемый для VG0. С другой стороны, мутант VG1 ( gdh2 Δ) показал пониженную приспособленность штамма, что иллюстрируется плохим μ max и сниженным Y S X . Эти неблагоприятные эффекты на приспособленность VG1 были частично устранены делецией PDC1 , о чем свидетельствуют несколько улучшенные значения μ max и Y S X для штамма VG3 ( pdc1Δgdh2Δ ). Снижение приспособленности штаммов, у которых был делетирован GDh2 , связано со сниженной скоростью ассимиляции азота [35]. В отсутствие GDh2 система GS-GOGAT (совместное взаимодействие двух ферментов, глутаматсинтазы, GLT1 , и глутаминсинтетазы, GLN1 ) [36, 37] и глутаматдегидрогеназы, кодируемой GDh3 [38], ответственны за ассимиляцию аммиака. Обе альтернативы используют NADH вместо NADPH, что объясняет высокую метаболическую адаптацию, предсказанную для GDh2 in silico мутантов (рис. 2B и 2C).По сравнению с Gdh2 сообщалось о более низкой активности для обеих альтернативных систем. Следовательно, сверхэкспрессия ферментов, участвующих в альтернативных путях, является необходимым шагом для восстановления клеточной приспособленности [39]. Мы экспериментировали со сверхэкспрессией GDh3 , поскольку использование системы GS-GOGAT имеет недостаток, связанный с использованием важного клеточного ресурса — АТФ.
Снижение приспособленности штаммов, у которых был делетирован GDh2 , связано со сниженной скоростью ассимиляции азота [35]. В отсутствие GDh2 система GS-GOGAT (совместное взаимодействие двух ферментов, глутаматсинтазы, GLT1 , и глутаминсинтетазы, GLN1 ) [36, 37] и глутаматдегидрогеназы, кодируемой GDh3 [38], ответственны за ассимиляцию аммиака. Обе альтернативы используют NADH вместо NADPH, что объясняет высокую метаболическую адаптацию, предсказанную для GDh2 in silico мутантов (рис. 2B и 2C).По сравнению с Gdh2 сообщалось о более низкой активности для обеих альтернативных систем. Следовательно, сверхэкспрессия ферментов, участвующих в альтернативных путях, является необходимым шагом для восстановления клеточной приспособленности [39]. Мы экспериментировали со сверхэкспрессией GDh3 , поскольку использование системы GS-GOGAT имеет недостаток, связанный с использованием важного клеточного ресурса — АТФ.
 Физиологические параметры эталонных и метаболически сконструированных штаммов при периодическом культивировании.
Физиологические параметры эталонных и метаболически сконструированных штаммов при периодическом культивировании.Полученный штамм VG4 ( pdc1Δgdh2Δ ↑ GDh3 ) продемонстрировал значительно улучшенную клеточную приспособленность по сравнению с VG3 со значениями μ max и Y S X , сходными с наблюдаемыми для VG2 и лучшими, чем полученные с VG0 В этих экспериментальных условиях (периодическое культивирование) ни одна из введенных мутаций, по-видимому, не влияет на продукцию этанола в какой-либо значительной степени, за исключением того, что штаммы, несущие делецию GDh2 , имеют тенденцию демонстрировать небольшое увеличение субстрат-специфического выхода этанола.
После роста всех четырех различных мутантов наблюдалось накопление нескольких промежуточных продуктов ванилинового пути. В сочетании протокатеховая кислота (PAC) и протокатеховый альдегид (PAL) составляли более 50% от общего количества образующихся продуктов. Ванилин, другие промежуточные и побочные продукты, такие как ванилиновая кислота и ванилиновый спирт, были обнаружены в очень малых количествах и не учитывались для дальнейшего анализа. Штамм VG1 показал самый низкий общий выход соединений, связанных с путем биосинтеза ванилина (рис. 3), что может быть связано с общим снижением приспособленности, наблюдаемым у этого штамма.Три других сконструированных штамма продемонстрировали лучшую производительность, чем VG0, в отношении продукции VG. Единичная делеция PDC1 в штамме VG2 привела к увеличению выхода VG на 52% и увеличению общего выхода соединений из ванилинового пути de novo на 30%. Несмотря на неблагоприятный эффект делеции GDh2 , двойная делеция PDC1 и GDh2 в VG3 привела к увеличению продукции VG на 15% по сравнению с VG0. В отличие от штамма VG0 выход VG увеличился более чем на 55% у штамма VG4.У всех штаммов увеличение VG сопровождалось накоплением PAC и PAL в разных относительных количествах (рис. 3). Наиболее желательное распределение среди этих метаболитов наблюдалось в случае ВГ2, где 50% всех образовавшихся продуктов составляли ВГ. В целом, инженерия штамма, проведенная в ходе этого исследования, привела нас от штамма, продуцирующего 9,8 мг VG /г glc , к штамму, продуцирующему 15,3 мг VG /г glc при периодическом культивировании.
Штамм VG1 показал самый низкий общий выход соединений, связанных с путем биосинтеза ванилина (рис. 3), что может быть связано с общим снижением приспособленности, наблюдаемым у этого штамма.Три других сконструированных штамма продемонстрировали лучшую производительность, чем VG0, в отношении продукции VG. Единичная делеция PDC1 в штамме VG2 привела к увеличению выхода VG на 52% и увеличению общего выхода соединений из ванилинового пути de novo на 30%. Несмотря на неблагоприятный эффект делеции GDh2 , двойная делеция PDC1 и GDh2 в VG3 привела к увеличению продукции VG на 15% по сравнению с VG0. В отличие от штамма VG0 выход VG увеличился более чем на 55% у штамма VG4.У всех штаммов увеличение VG сопровождалось накоплением PAC и PAL в разных относительных количествах (рис. 3). Наиболее желательное распределение среди этих метаболитов наблюдалось в случае ВГ2, где 50% всех образовавшихся продуктов составляли ВГ. В целом, инженерия штамма, проведенная в ходе этого исследования, привела нас от штамма, продуцирующего 9,8 мг VG /г glc , к штамму, продуцирующему 15,3 мг VG /г glc при периодическом культивировании.
Выход β-D-глюкозида ванилина, наблюдаемый для эталонного штамма (VG0) и метаболически модифицированных мутантов (VG1-4) при периодическом культивировании .Общий выход субстрата для ванилина β-D-глюкозида (Y S VG , мг VG / г glc ), протокатеховой кислоты (Y S PAC , мг PAC / г glc 902) (Y S PAL , мг PAL /г glc ), полученные для эталонных и сконструированных штаммов в периодической культуре. Представлены круговые диаграммы, иллюстрирующие относительное распределение PAC, PAL и VG для каждого штамма.
Степень, в которой производство ВГ зависит от наличия или отсутствия спиртового брожения, до сих пор неизвестна.Выше критического порога скорости поглощения глюкозы имеет место сосуществование дыхания и ферментации, а выход биомассы значительно ниже из-за направления углерода в сторону этанола, известного как эффект Крэбтри [28]. Это явление, также называемое избыточным метаболизмом, обычно наблюдается при периодическом культивировании, когда исходная концентрация глюкозы обычно выше критического порога для смешанного метаболизма. При культивировании на хемостате концентрация глюкозы поддерживается на очень низком уровне и ниже критической скорости разведения (штамм-специфичной), скорость поглощения глюкозы достаточно низка, чтобы обеспечить исключительно дыхательный метаболизм [27, 40, 41].
Это явление, также называемое избыточным метаболизмом, обычно наблюдается при периодическом культивировании, когда исходная концентрация глюкозы обычно выше критического порога для смешанного метаболизма. При культивировании на хемостате концентрация глюкозы поддерживается на очень низком уровне и ниже критической скорости разведения (штамм-специфичной), скорость поглощения глюкозы достаточно низка, чтобы обеспечить исключительно дыхательный метаболизм [27, 40, 41].
Дыхательный и ферментативный метаболизм для продукции VG
В попытке проверить, приведет ли пониженная ферментация к увеличению биомассы и/или продукции VG, был выбран эталонный штамм VG0 и наиболее продуктивные мутанты в периодическом культивировании (VG2 и VG4) для дальнейшая характеристика в хемостатных культурах с ограниченным содержанием глюкозы при скорости разбавления 0,1 ч -1 и концентрации глюкозы в корме 20 г/л. VG2 продемонстрировал повышенную приспособленность, о чем свидетельствует более высокий выход биомассы (Y S X ), сопровождаемый небольшим увеличением выхода этанола и небольшим снижением выхода глицерина по сравнению с VG0 (таблица 2). В этих условиях VG2 показывает 5,6 мг VG /г glc , что на 40% выше выхода VG, чем VG0. Напротив, VG4 показал значительное снижение Y SX , в то время как продукция этанола и глицерина была значительно увеличена (таблица 2). В то же время продукция VG, наблюдаемая для этого штамма, остается очень похожей на продукцию эталонного штамма ( Таблица 2).
В этих условиях VG2 показывает 5,6 мг VG /г glc , что на 40% выше выхода VG, чем VG0. Напротив, VG4 показал значительное снижение Y SX , в то время как продукция этанола и глицерина была значительно увеличена (таблица 2). В то же время продукция VG, наблюдаемая для этого штамма, остается очень похожей на продукцию эталонного штамма ( Таблица 2).
Штамм VG0 показал скорость поглощения глюкозы (r S ) 3,9 ± 0,2 ммоль glc g gw -1 .h -1 , тогда как VG2 имеет скорость поглощения 3,9 ± 0,2 ммоль glc g gw -1 .ч -1 . Более низкое поглощение глюкозы снижает избыточный метаболизм у штамма, что приводит к снижению скорости образования этанола, глицерина и ацетата. В то же время VG2 демонстрирует более высокую конверсию PAC в продукты более поздних стадий ванилинового пути (рис. 4А).Штамм VG4 демонстрирует более низкий выход биомассы по отношению к глюкозе и соответствующее более высокое значение r S , что указывает на повышенный избыточный метаболизм (таблица 2). Соответственно, наблюдалось значительно увеличенное производство этанола (в 1,5 раза) и глицерина (в 4 раза). Несмотря на серьезное влияние избыточного метаболизма на выход биомассы штамма VG4 в тестируемых условиях, наблюдалось лучшее превращение PAC в нижестоящие метаболиты, особенно в PAL (рис. 4A). Возможная интерпретация этого результата заключается в том, что штамм VG4 имеет более высокую доступность NADPH из-за искусственно сниженной потребности в этом кофакторе для метаболизма аммония.Это, скорее всего, обеспечивает термодинамически более благоприятное превращение PAC в PAL, как предполагалось во время выбора мишени.
В то же время VG2 демонстрирует более высокую конверсию PAC в продукты более поздних стадий ванилинового пути (рис. 4А).Штамм VG4 демонстрирует более низкий выход биомассы по отношению к глюкозе и соответствующее более высокое значение r S , что указывает на повышенный избыточный метаболизм (таблица 2). Соответственно, наблюдалось значительно увеличенное производство этанола (в 1,5 раза) и глицерина (в 4 раза). Несмотря на серьезное влияние избыточного метаболизма на выход биомассы штамма VG4 в тестируемых условиях, наблюдалось лучшее превращение PAC в нижестоящие метаболиты, особенно в PAL (рис. 4A). Возможная интерпретация этого результата заключается в том, что штамм VG4 имеет более высокую доступность NADPH из-за искусственно сниженной потребности в этом кофакторе для метаболизма аммония.Это, скорее всего, обеспечивает термодинамически более благоприятное превращение PAC в PAL, как предполагалось во время выбора мишени.
Выход β-D-глюкозида ванилина, наблюдаемый для эталонного штамма (VG0) и метаболически модифицированных мутантов (VG1-4) при непрерывном культивировании . A — Удельная производительность биомассы (мг metab .g dw -1 .h -1 ) для протокатеховой кислоты (PAC), протокатехового альдегида (PAL) и VG при культивировании хемостата с ограничением глюкозы при разбавлении скорость 0.1 ч- 1 . B — Удельный выход субстрата (Y S Metab , мг метаб / г glc ) для PAC, PAL и VG для штаммов VG0 и VG2 при культивировании с ограниченным содержанием глюкозы в хемостате при различных скоростях разбавления — 0,1 ч- 1 (сверху) и 0,015 ч- 1 (*, снизу).
A — Удельная производительность биомассы (мг metab .g dw -1 .h -1 ) для протокатеховой кислоты (PAC), протокатехового альдегида (PAL) и VG при культивировании хемостата с ограничением глюкозы при разбавлении скорость 0.1 ч- 1 . B — Удельный выход субстрата (Y S Metab , мг метаб / г glc ) для PAC, PAL и VG для штаммов VG0 и VG2 при культивировании с ограниченным содержанием глюкозы в хемостате при различных скоростях разбавления — 0,1 ч- 1 (сверху) и 0,015 ч- 1 (*, снизу).
Преимущественно респираторно-ферментативный метаболизм, наблюдаемый для всех сконструированных штаммов (VG0, VG2 и VG4), подразумевает, что критическая скорость разбавления (указывающая на респираторную способность) штаммов очень низка.Постепенно уменьшая скорость разведения в хемостате с ограничением по глюкозе, мы подтвердили, что критическая скорость разведения как для VG2, так и для VG0 была ниже 0,015. Такая низкая дыхательная способность может быть результатом комбинированного воздействия токсичности продукта/побочных продуктов и фона штамма. Использование этой экспериментальной установки позволило снизить скорость производства этанола до 0,130 ммоль eth g gw -1 .h -1 для VG0 и до 0,065 ммоль eth g gw 0 .ч -1 для ВГ2, тогда как скорость поглощения глюкозы составила 0,37 и 0,30 ммоль гжк г гв -1 .ч -1 соответственно. С VG2 концентрация VG в бульоне составляла 500 мг/л (32 мг VG /г glc ), что вдвое больше по сравнению с VG0, который давал 250 мг/л (15 мг VG ). /г glc ) (Фигура 4В). Эти результаты подтверждают, что VG2 имеет лучшую дыхательную способность, чем эталонный штамм VG0, и что снижение избыточного метаболизма приводит к более высокому выходу VG.Тот факт, что более высокие выходы промежуточных продуктов PAC и PAL, а также конечного продукта, VG, получают при низких скоростях разбавления, предполагает значительно увеличенный поток через путь биосинтеза ванилина.
Такая низкая дыхательная способность может быть результатом комбинированного воздействия токсичности продукта/побочных продуктов и фона штамма. Использование этой экспериментальной установки позволило снизить скорость производства этанола до 0,130 ммоль eth g gw -1 .h -1 для VG0 и до 0,065 ммоль eth g gw 0 .ч -1 для ВГ2, тогда как скорость поглощения глюкозы составила 0,37 и 0,30 ммоль гжк г гв -1 .ч -1 соответственно. С VG2 концентрация VG в бульоне составляла 500 мг/л (32 мг VG /г glc ), что вдвое больше по сравнению с VG0, который давал 250 мг/л (15 мг VG ). /г glc ) (Фигура 4В). Эти результаты подтверждают, что VG2 имеет лучшую дыхательную способность, чем эталонный штамм VG0, и что снижение избыточного метаболизма приводит к более высокому выходу VG.Тот факт, что более высокие выходы промежуточных продуктов PAC и PAL, а также конечного продукта, VG, получают при низких скоростях разбавления, предполагает значительно увеличенный поток через путь биосинтеза ванилина. В обоих штаммах наблюдаемое превращение PAL в VG более эффективно при низких скоростях разведения. Это подтверждает, что низкий избыточный метаболизм связан с повышенным поступлением предшественников и/или кофакторов, что обеспечивает более высокую продуктивность VG.
В обоих штаммах наблюдаемое превращение PAL в VG более эффективно при низких скоростях разведения. Это подтверждает, что низкий избыточный метаболизм связан с повышенным поступлением предшественников и/или кофакторов, что обеспечивает более высокую продуктивность VG.
Анализ экспериментальных результатов
В попытке лучше понять изменения метаболического потока на уровне всей сети и, следовательно, основу для наблюдаемого улучшения производства VG, фенотипы потока VG0, VG2 и VG4 были смоделированы с использованием ФБА [17].Экспериментальные результаты, полученные от хемостатных культур, т.е. скорость поглощения глюкозы и выход биомассы, скорость производства этанола, ацетата, глицерина и CO 2 , были добавлены в качестве ограничений в метаболическую модель. Границы удаленных генов были установлены равными нулю, как и в случае делеции GDh2 в VG4. Однако выбор ограничений для делеции PDC1 не является простым, поскольку удаление PDC1 не означает, что активность пируватдекарбоксилазы будет равна нулю. Чтобы обойти эту проблему и учесть разные скорости поглощения глюкозы мутантами, в каждом состоянии определяли верхнюю границу потока PDC. Впоследствии фенотипы были смоделированы с верхней границей для PDC, ограниченной 80% ранее найденной верхней границы.
Чтобы обойти эту проблему и учесть разные скорости поглощения глюкозы мутантами, в каждом состоянии определяли верхнюю границу потока PDC. Впоследствии фенотипы были смоделированы с верхней границей для PDC, ограниченной 80% ранее найденной верхней границы.
Анализ изменчивости потоков
Распределения потоков, полученные с помощью FBA, гарантированно будут оптимальными, но не обязательно уникальными из-за существования большого количества альтернативных маршрутов. Это делает преобразование экспериментально определенных уровней полученных продуктов во внутриклеточные потоки сложной задачей.Тем не менее, стехиометрическое моделирование позволяет оценить возможный диапазон значений потока для каждой реакции в сети. Уникальные потоки будут иметь одинаковые максимальное и минимальное возможные значения. Диапазоны потоков всех реакций VG2 и VG4 были рассчитаны и сравнены с диапазонами VG0, что привело к разным категориям, как показано на рисунке 5. Первая категория состоит из тех реакций, для которых поток невозможен в стационарном состоянии, т.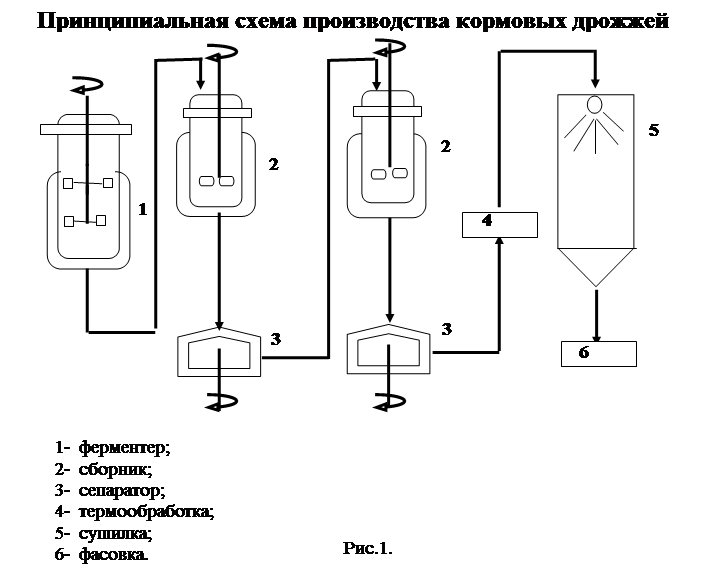 е. заблокированных реакций. Среди оставшихся реакций (~570) только 50 имеют уникальные значения потока для эталонного штамма и для мутантов (VG2 и VG4).Почти все эти реакции относятся к категории a , т.е. без различий между эталонным штаммом VG0 и тестируемыми мутантами. Эксперименты с хемостатом проводились при одинаковой степени разбавления для всех штаммов, и, как следствие, моделирование реакций, непосредственно связанных с биосинтезом биомассы, подпадает под эту категорию. Примеры включают реакции метаболизма липидов, нуклеотидов и аминокислот.
е. заблокированных реакций. Среди оставшихся реакций (~570) только 50 имеют уникальные значения потока для эталонного штамма и для мутантов (VG2 и VG4).Почти все эти реакции относятся к категории a , т.е. без различий между эталонным штаммом VG0 и тестируемыми мутантами. Эксперименты с хемостатом проводились при одинаковой степени разбавления для всех штаммов, и, как следствие, моделирование реакций, непосредственно связанных с биосинтезом биомассы, подпадает под эту категорию. Примеры включают реакции метаболизма липидов, нуклеотидов и аминокислот.
Анализ изменчивости потока .Реакции классифицировали на основе сравнения диапазона изменчивости их потока между эталоном VG0 и мутантами VG2 и VG4. A — схема с левой стороны иллюстрирует диапазоны изменчивости потока, определяющие шесть различных категорий (блокировка и a до e ). Диапазон изменчивости потока для эталонного штамма (VG0) представлен серым цветом, а мутанта — черным. Распределение реакций VG2 и VG4 по разным категориям представлено на гистограмме желтого и красного цвета соответственно. B — Реакции мутанта VG2, относящиеся к категориям b и c , дополнительно классифицируются в соответствии с их метаболической функцией.
Распределение реакций VG2 и VG4 по разным категориям представлено на гистограмме желтого и красного цвета соответственно. B — Реакции мутанта VG2, относящиеся к категориям b и c , дополнительно классифицируются в соответствии с их метаболической функцией.
Категории b и c содержат большинство реакций (~70%) для штаммов VG2 и VG4, однако распределение между двумя категориями для двух мутантных штаммов неодинаково. В случае VG2 226 реакций демонстрируют больший диапазон, чем наблюдаемый для эталонного штамма (категория b ), и аналогичное количество реакций демонстрирует меньший диапазон, чем наблюдаемый в VG0 (категория c ).Для штамма VG4 большинство реакций попадают в категорию b , как и ожидалось, из-за его более высокой скорости поглощения глюкозы. Штамм VG2 демонстрирует пониженную скорость поглощения глюкозы и такую же скорость образования биомассы, как и VG0. Тем не менее, несколько реакций центрального углеродного метаболизма демонстрируют повышенный диапазон потоков (категория b ). Эти реакции в основном относятся к циклу трикарбоновых кислот (TCA), пентозофосфатному пути и глюконеогенезу, отражая, что у этого штамма снижен избыточный метаболизм и продукция этанола.Более активное дыхание у этого штамма дополнительно подтверждается предсказанным in silico увеличением скорости поглощения кислорода. Несмотря на то, что эта реакция встречается в категории c (с уменьшенным диапазоном потоков), ее нижняя граница выше в VG2, чем в VG0.
Эти реакции в основном относятся к циклу трикарбоновых кислот (TCA), пентозофосфатному пути и глюконеогенезу, отражая, что у этого штамма снижен избыточный метаболизм и продукция этанола.Более активное дыхание у этого штамма дополнительно подтверждается предсказанным in silico увеличением скорости поглощения кислорода. Несмотря на то, что эта реакция встречается в категории c (с уменьшенным диапазоном потоков), ее нижняя граница выше в VG2, чем в VG0.
В остальных реакциях представлены диапазоны изменчивости потока с частичным перекрытием или без перекрытия между эталонным штаммом и мутантами. Эти реакции были сгруппированы в категорию d , где верхняя граница потока мутантов выше верхней границы эталонного потока, и категорию e , где нижняя граница потока мутантов ниже нижней границы эталонного потока.Вместе категории d и e включают реакции с наиболее четкими различиями между мутантами и эталоном. К ним относятся реакции, связанные с образованием продуктов (например, биосинтез S-аденозилметионина — донора метильной группы в ванилиновом пути) и поглощением глюкозы (что было установлено экспериментально), а также реакции метаболизма аммиака.
Несмотря на повышенную продукцию VG, штамм VG2 демонстрирует пониженный поток через путь биосинтеза ароматических аминокислот, из которого получают предшественник ванилина.Точно так же этот штамм демонстрирует сниженный общий поток через путь VG. Та же тенденция была обнаружена для штамма VG4, подразумевая, что метаболическая сеть корректируется для увеличения производства PAL и VG за счет уменьшения общего потока углерода в ароматические аминокислоты до ветви биосинтеза VG. На самом деле реакция, после которой продукция увеличивается, представляет собой превращение PAC в PAL. В этой реакции используются НАДФН и АТФ, два наиболее тесно связанных метаболита и кофактора, за которые конкурируют потребности роста.
Анализ, ориентированный на метаболиты
Для систематического изучения использования кофакторов и других метаболитов в сконструированных штаммах оборот этих метаболитов можно рассчитать путем суммирования всех потоков, которые их производят (или потребляют) [42]. Поскольку уникальные значения всех потоков неизвестны из-за альтернативных оптимумов, присущих FBA метаболических сетей, минимальный оборот метаболитов рассчитывали путем решения задачи линейного программирования (ЗПП) для минимизации оборота метаболитов (см. материалы и методы для Детали).Эта формулировка LPP гарантирует нахождение минимального оборота данного метаболита, обеспечивающего наблюдаемый фенотип. Направление оптимизации, т. е. минимизация, не только позволяет избежать несвязанных циклических потоков вокруг рассматриваемого метаболита, но также соответствует биологической гипотезе о минимальном распределении ресурсов клеткой с точки зрения экспрессии фермента. Минимальный оборот метаболита показывает, сколько потока необходимо пройти через данный метаболит, хотя распределение этого потока среди возможных реакций не может быть уникальным во всех случаях.Тем не менее оборот, рассчитанный таким образом, дает нижнюю границу потока через метаболит, который можно использовать в дополнение к анализу изменчивости потока.
Поскольку уникальные значения всех потоков неизвестны из-за альтернативных оптимумов, присущих FBA метаболических сетей, минимальный оборот метаболитов рассчитывали путем решения задачи линейного программирования (ЗПП) для минимизации оборота метаболитов (см. материалы и методы для Детали).Эта формулировка LPP гарантирует нахождение минимального оборота данного метаболита, обеспечивающего наблюдаемый фенотип. Направление оптимизации, т. е. минимизация, не только позволяет избежать несвязанных циклических потоков вокруг рассматриваемого метаболита, но также соответствует биологической гипотезе о минимальном распределении ресурсов клеткой с точки зрения экспрессии фермента. Минимальный оборот метаболита показывает, сколько потока необходимо пройти через данный метаболит, хотя распределение этого потока среди возможных реакций не может быть уникальным во всех случаях.Тем не менее оборот, рассчитанный таким образом, дает нижнюю границу потока через метаболит, который можно использовать в дополнение к анализу изменчивости потока.
Помимо НАДФН и АТФ, также был рассчитан минимальный оборот некоторых других соответствующих метаболитов (рис. 6). Минимальный оборот PAC у штаммов VG2 и VG4 ниже, чем у VG0; в то время как для PAL и VG подтверждается противоположная тенденция, что согласуется с анализом изменчивости потока. Увеличение скорости поглощения глюкозы приведет к увеличению гликолиза и пентозофосфатного пути, что отражается в увеличении минимального оборота пирувата и эритрозо-4-фосфата в штамме VG4.С другой стороны, штамм VG2 демонстрирует пониженную скорость поглощения глюкозы и, следовательно, меньший поток через гликолиз и пентозофосфатный путь. Те же тенденции применимы к АТФ, подразумевая, что большая часть АТФ, доступного в клетке, производится в результате гликолиза. Минимальные обороты НАДФН, S-аденозилметионина и УДФ-глюкозы увеличены для обоих смоделированных фенотипов, что отражает увеличение потока через ACAR, hsOMT и UGT, приводящее к PAL и VG. Вышеприведенный анализ дает представление об изменениях внутриклеточного потока и определяет метаболиты, которые играют роль в сконструированных штаммах.
Минимальный оборот выбранных метаболитов центрального углеродного метаболизма и пути биосинтеза VG (включая кофакторы). Метаболиты центрального углеродного обмена: глюкозо-6-фосфат, эритрозо-4-фосфат, пируват и этанол; Метаболиты пути биосинтеза ВГ (АТФ, НАДФН, САМ и УДФ-глюкоза). Метаболиты, для которых был рассчитан минимальный оборот, представлены закрашенными кружками, метаболиты, для которых не был рассчитан минимальный оборот, представлены незакрашенными кольцами.Реакции представлены стрелками. Качественное изменение минимальных оборотов относительно эталона (VG0) показано стрелками рядом с каждым метаболитом; желтый соответствует VG2, а красный соответствует VG4.
В ходе этого исследования были успешно сконструированы и созданы три штамма, продуцирующие VG. Инструменты системной биологии, такие как модель в масштабе генома дрожжей, использовались на протяжении всего исследования, от дизайна штамма до анализа физиологических данных, полученных в результате исследований ферментации сконструированных мутантов. Предсказываемое in silico увеличение выхода продукта было более чем в 2 раза (рис. 2А). Действительно, для одного из мутантов наблюдалось двукратное увеличение выхода, хотя и при низкой степени разбавления. С другой стороны, наблюдаемое улучшение при периодическом культивировании было близко к 1,5-кратному увеличению. Ограниченная кинетическая и регуляторная информация, а также отсутствие инструментов для интеграции такой информации в метаболические модели в масштабе генома являются основными вероятными причинами несоответствия между предсказанным и экспериментально определенным выходом.Необходимость учета регуляторной информации становится еще более очевидной, если учесть тот факт, что в качестве мишени был выбран изофермент. Трудно предсказать влияние делеции гена, кодирующего изофермент, на перенаправление потока. В действительности количественное предсказание распределения потока после подавления или сверхэкспрессии гена (или соответствующей активности фермента) все еще находится в зачаточном состоянии.
Предсказываемое in silico увеличение выхода продукта было более чем в 2 раза (рис. 2А). Действительно, для одного из мутантов наблюдалось двукратное увеличение выхода, хотя и при низкой степени разбавления. С другой стороны, наблюдаемое улучшение при периодическом культивировании было близко к 1,5-кратному увеличению. Ограниченная кинетическая и регуляторная информация, а также отсутствие инструментов для интеграции такой информации в метаболические модели в масштабе генома являются основными вероятными причинами несоответствия между предсказанным и экспериментально определенным выходом.Необходимость учета регуляторной информации становится еще более очевидной, если учесть тот факт, что в качестве мишени был выбран изофермент. Трудно предсказать влияние делеции гена, кодирующего изофермент, на перенаправление потока. В действительности количественное предсказание распределения потока после подавления или сверхэкспрессии гена (или соответствующей активности фермента) все еще находится в зачаточном состоянии. Достижения в этой области потребуют большего количества экспериментальных данных о регуляции метаболических сетей, а также инструментов моделирования потоков, которые могут интегрировать такую информацию.Регуляция как на иерархическом, так и на метаболическом уровне имеет особое значение для производства ванилина, поскольку шикиматный путь биосинтеза ароматических аминокислот жестко регулируется у дрожжей [43]. Например, Луттик и его коллеги смогли увеличить общий поток через этот путь в 4,5 раза у S. cerevisiae за счет облегчения механизмов ингибирования обратной связи DAHP-синтазы [44].
Достижения в этой области потребуют большего количества экспериментальных данных о регуляции метаболических сетей, а также инструментов моделирования потоков, которые могут интегрировать такую информацию.Регуляция как на иерархическом, так и на метаболическом уровне имеет особое значение для производства ванилина, поскольку шикиматный путь биосинтеза ароматических аминокислот жестко регулируется у дрожжей [43]. Например, Луттик и его коллеги смогли увеличить общий поток через этот путь в 4,5 раза у S. cerevisiae за счет облегчения механизмов ингибирования обратной связи DAHP-синтазы [44].
Простой и быстрый протокол получения дрожжевого экстракта из Saccharomyces cerevisiae, подходящего для приготовления бактериальных культуральных сред
Iran J Pharm Res.2016 Осень; 15(4): 907–913.
Омид Зарей
a Исследовательский центр биотехнологии, Тебризский университет медицинских наук, Тебриз, Иран.
b Кафедра фармацевтической биотехнологии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран.
c Студенческий исследовательский комитет, Тебризский университет медицинских наук, Тебриз, Иран.
Сиавуш Дастмалчи
a Исследовательский центр биотехнологии, Тебризский университет медицинских наук, Тебриз, Иран.
d Кафедра медицинской химии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран.
Марьям Хамзе-Мивехруд
a Исследовательский центр биотехнологии, Тебризский университет медицинских наук, Тебриз, Иран.
d Кафедра медицинской химии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран.
a Исследовательский центр биотехнологии, Тебризский университет медицинских наук, Тебриз, Иран.
b Кафедра фармацевтической биотехнологии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран.
c Студенческий исследовательский комитет, Тебризский университет медицинских наук, Тебриз, Иран.
d Кафедра медицинской химии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран.
* Автор, ответственный за переписку: Электронная почта: Hamzehm@tbzmed.ак.ир; [email protected]
Получено в феврале 2015 г.; Принят в мае 2015 г.
Copyright © 2016 Фармацевтическая школа Университета медицинских наук и здравоохранения им. Шахида Бехешти Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License (http://creativecommons.org/licenses/by/3.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа правильно цитируется.Эта статья была процитирована другими статьями в PMC.Abstract
Дрожжи, особенно Saccharomyces cerevisiae, , являются одним из старейших организмов с широким спектром применения благодаря своей уникальной генетике и физиологии. Экстракт дрожжей, то есть продукт дрожжевых клеток, широко используется в качестве питательного ресурса в бактериальных культуральных средах.
Экстракт дрожжей, то есть продукт дрожжевых клеток, широко используется в качестве питательного ресурса в бактериальных культуральных средах.
Целью данного исследования была разработка простого, быстрого и рентабельного процесса производства дрожжевого экстракта. В этой процедуре для получения дрожжевого экстракта использовались механические методы, такие как высокая температура и давление.Рост бактерий, подаваемых с полученным дрожжевым экстрактом, отслеживали для оценки качества продукта. Результаты показали, что качество полученного дрожжевого экстракта было очень многообещающим, о чем свидетельствует картина роста бактериальных клеток в среде, приготовленной из этого продукта, и было сравнимо с качеством трех коммерческих дрожжевых экстрактов с точки зрения свойств роста бактерий. Одним из основных преимуществ текущего метода было то, что не использовались химикаты и ферменты, что привело к снижению производственных затрат.Этот метод очень прост и эффективен с точки зрения затрат, и может быть выполнен в разумные сроки, что делает его пригодным для использования в исследовательских лабораториях. Кроме того, его можно масштабировать для производства больших количеств для промышленного применения.
Кроме того, его можно масштабировать для производства больших количеств для промышленного применения.
Ключевые слова: Пекарские дрожжи, дрожжевой экстракт, рост бактерий, Saccharomyces cerevisiae
Введение
Дрожжи являются важными эукариотическими микроорганизмами, принадлежащими к царству грибов. С исторической точки зрения, тысячи лет назад они использовались для самых разных целей, таких как ферментация, выпечка и биоремедиация (1-3), а также для широкого спектра исследований в биологических науках благодаря их уникальной генетике и физиологии. (4-8).Кроме того, питательные вещества клеток дрожжей, известные как «дрожжевой экстракт», также используются для многих важных целей. Экстракт дрожжей представляет собой переработанный дрожжевой продукт, который содержит растворимые компоненты дрожжевых клеток и широко используется в пищевой промышленности в качестве пищевых ароматизаторов, добавок и витаминных добавок, а также в качестве питательного ресурса для бактериальных культуральных сред, используемых в микробиологии и биотехнологии (9-10). Более того, важность использования дрожжевого экстракта в промышленной ферментации для производства микробной биомассы или продуктов была доказана многочисленными исследованиями (11-14).Различные виды дрожжей, особенно Saccharomyces cerevisiae (известные как пекарские дрожжи), использовались для производства дрожжевого экстракта (15-17). Экстракт дрожжей производится с использованием различных методов, таких как методы, основанные на методах автолиза и гидролиза. Целью различных методов является разрушение клеточной стенки дрожжей (для высвобождения клеточного содержимого) и восстановление растворимой фракции. В зависимости от цели производства процедура получения дрожжевого экстракта различается. Например, если целью производства дрожжевого экстракта является использование его в пищевой или косметической промышленности, требуется несколько этапов для получения пищевого/косметического дрожжевого экстракта.Эти стадии включают множество физических, химических и ферментативных методов разрушения клеточной стенки дрожжей, за которыми следуют несколько дополнительных стадий, таких как фильтрация, хроматография или другие методы разделения для удаления нерастворимых материалов с целью получения продукта без запаха, вкуса и цвета (18-19).
Более того, важность использования дрожжевого экстракта в промышленной ферментации для производства микробной биомассы или продуктов была доказана многочисленными исследованиями (11-14).Различные виды дрожжей, особенно Saccharomyces cerevisiae (известные как пекарские дрожжи), использовались для производства дрожжевого экстракта (15-17). Экстракт дрожжей производится с использованием различных методов, таких как методы, основанные на методах автолиза и гидролиза. Целью различных методов является разрушение клеточной стенки дрожжей (для высвобождения клеточного содержимого) и восстановление растворимой фракции. В зависимости от цели производства процедура получения дрожжевого экстракта различается. Например, если целью производства дрожжевого экстракта является использование его в пищевой или косметической промышленности, требуется несколько этапов для получения пищевого/косметического дрожжевого экстракта.Эти стадии включают множество физических, химических и ферментативных методов разрушения клеточной стенки дрожжей, за которыми следуют несколько дополнительных стадий, таких как фильтрация, хроматография или другие методы разделения для удаления нерастворимых материалов с целью получения продукта без запаха, вкуса и цвета (18-19). ). Хотя качество дрожжевого экстракта улучшается за счет применения этих дополнительных процедур, большинство из этих стадий являются очень трудоемкими, длительными, дорогими и несущественными, когда целью производства является использование дрожжевого экстракта для микробиологических исследований в качестве одного из основных компонентов. сред для культивирования бактериальных клеток.
). Хотя качество дрожжевого экстракта улучшается за счет применения этих дополнительных процедур, большинство из этих стадий являются очень трудоемкими, длительными, дорогими и несущественными, когда целью производства является использование дрожжевого экстракта для микробиологических исследований в качестве одного из основных компонентов. сред для культивирования бактериальных клеток.
Несмотря на наличие многочисленных коммерческих дрожжевых экстрактов для приготовления микробных культуральных сред, простой метод приготовления высококачественного дрожжевого экстракта будет очень полезен. Принимая во внимание важность и широкий спектр применения дрожжевого экстракта в средах микробного брожения, наша цель в текущем исследовании состояла в том, чтобы разработать простой, быстрый и рентабельный процесс производства дрожжевого экстракта, применимого в различных лабораториях, чтобы удовлетворить экспериментальных потребностей, а также для использования в промышленности в качестве основного компонента среды микробного брожения в больших количествах.
Материалы и методы
Приготовление дрожжевого экстракта
Водную суспензию клеток дрожжей готовили путем добавления 500 г пекарских дрожжей ( Saccharomyces cerevisiae ) к 2 л деионизированной воды (вода Milli-Q). Приготовленную суспензию автоклавировали при 115 °С в течение 10 мин с последующим быстрым охлаждением на льду. Затем клеточный дебрис отделяли центрифугированием при 400 g при 4°С в течение 10 мин. Супернатант повторно центрифугировали снова при тех же условиях, чтобы убедиться в удалении нерастворимого клеточного содержимого.Полученный супернатант, содержащий растворимый компонент, повторно автоклавировали и снова охлаждали, как описано выше. Полученный водорастворимый экстракт хранили при –20 °С до получения дрожжевого экстракта в виде порошка. Затем растворимую фракцию подвергали мини-распылительной сушилке (B-290, Büchi Labortechnik AG, Flawil, Швейцария) для получения порошкообразной формы дрожжевого экстракта.
Оценка роста бактериальных клеток
Для оценки качества продукта контролировали рост бактерий, питаемых полученным дрожжевым экстрактом. С этой целью готовили различные питательные среды для бактерий в твердом или жидком виде. В первом подходе мы использовали только дрожжевой экстракт в качестве единственного источника питательных веществ в средах для культивирования бактериальных клеток. Для этой цели твердые и жидкие среды готовили по следующему протоколу: для твердой среды смесь 8 г полученного порошка дрожжевого экстракта и 15 г агара (Merck, Дармштадт, Германия) растворяли в 1 л деионизированной воды и автоклавировали (121°С). C, 15 фунтов) в течение 15 мин с последующим распределением в стерильные пластиковые чашки диаметром 8 см.В качестве среды отрицательного контроля также готовили аналогичную твердую среду без порошка дрожжевого экстракта. Для жидкой среды 20 г полученного порошка дрожжевого экстракта растворяли в конечном объеме 1 л деионизированной воды и автоклавировали, как указано выше. Охлажденную среду разливают по стерильным пробиркам. Также была приготовлена аналогичная среда отрицательного контроля (т.
С этой целью готовили различные питательные среды для бактерий в твердом или жидком виде. В первом подходе мы использовали только дрожжевой экстракт в качестве единственного источника питательных веществ в средах для культивирования бактериальных клеток. Для этой цели твердые и жидкие среды готовили по следующему протоколу: для твердой среды смесь 8 г полученного порошка дрожжевого экстракта и 15 г агара (Merck, Дармштадт, Германия) растворяли в 1 л деионизированной воды и автоклавировали (121°С). C, 15 фунтов) в течение 15 мин с последующим распределением в стерильные пластиковые чашки диаметром 8 см.В качестве среды отрицательного контроля также готовили аналогичную твердую среду без порошка дрожжевого экстракта. Для жидкой среды 20 г полученного порошка дрожжевого экстракта растворяли в конечном объеме 1 л деионизированной воды и автоклавировали, как указано выше. Охлажденную среду разливают по стерильным пробиркам. Также была приготовлена аналогичная среда отрицательного контроля (т. е. среда без дрожжевого экстракта). Для культивирования в приготовленных средах использовали бактерии E. coli (DH5α) и Staphylococcus aureus (PTCC 1112) в виде грамотрицательных и грамположительных бактерий соответственно.Для твердых сред бактерии высевали штрихом на чашку и инкубировали в течение ночи при 37°С. В случае жидких сред свежую ночную культуру бактерий разбавляли 1:100 в среде и инкубировали при 37°С при встряхивании со скоростью 180 об/мин. Через разные промежутки времени (т.е. 2, 4, 8, 16, 24 и 48 ч) в стерильных условиях отбирали образцы для мониторинга роста бактерий в приготовленных средах путем считывания оптической плотности (ОП) образцов при 600 нм с использованием УФ-излучения. спектрофотометр (Ultrospec 2000, Amersham Pharmacia Biotech).Каждый эксперимент проводили в трехкратной повторности.
е. среда без дрожжевого экстракта). Для культивирования в приготовленных средах использовали бактерии E. coli (DH5α) и Staphylococcus aureus (PTCC 1112) в виде грамотрицательных и грамположительных бактерий соответственно.Для твердых сред бактерии высевали штрихом на чашку и инкубировали в течение ночи при 37°С. В случае жидких сред свежую ночную культуру бактерий разбавляли 1:100 в среде и инкубировали при 37°С при встряхивании со скоростью 180 об/мин. Через разные промежутки времени (т.е. 2, 4, 8, 16, 24 и 48 ч) в стерильных условиях отбирали образцы для мониторинга роста бактерий в приготовленных средах путем считывания оптической плотности (ОП) образцов при 600 нм с использованием УФ-излучения. спектрофотометр (Ultrospec 2000, Amersham Pharmacia Biotech).Каждый эксперимент проводили в трехкратной повторности.
В качестве дополнительной оценки рост бактерий отслеживали в бульонной среде Лурия Бертани (обычно используемой в микробиологии среде), приготовленной с использованием дрожжевого экстракта, полученного в этом исследовании, и экстрактов, полученных от коммерческих поставщиков. Бульонную среду LB готовили следующим образом: 5 г порошка дрожжевого экстракта, 10 г триптона (HiMedia, кат. №: RM014) и 5 г NaCl (Scharlau, кат. №: SO0225) растворяли в 1 л деионизированной воды с последующим автоклавирование и розлив в стерильные пробирки.Чтобы сравнить профиль роста бактериальных клеток в среде, приготовленной из дрожжевого экстракта нашего производства, с аналогичными коммерческими продуктами дрожжевого экстракта, были использованы три разных дрожжевых экстракта известных компаний, а именно Sigma (кат. №:-F), Merck ( № по каталогу: 1.03753) и Applichem (№ по каталогу: A3732). Среду, содержащую все ингредиенты, кроме дрожжевого экстракта, готовили и использовали в качестве отрицательной контрольной среды. Все процедуры, связанные с бактериальным культивированием и мониторингом роста бактериальных клеток, проводили, как описано выше.
Бульонную среду LB готовили следующим образом: 5 г порошка дрожжевого экстракта, 10 г триптона (HiMedia, кат. №: RM014) и 5 г NaCl (Scharlau, кат. №: SO0225) растворяли в 1 л деионизированной воды с последующим автоклавирование и розлив в стерильные пробирки.Чтобы сравнить профиль роста бактериальных клеток в среде, приготовленной из дрожжевого экстракта нашего производства, с аналогичными коммерческими продуктами дрожжевого экстракта, были использованы три разных дрожжевых экстракта известных компаний, а именно Sigma (кат. №:-F), Merck ( № по каталогу: 1.03753) и Applichem (№ по каталогу: A3732). Среду, содержащую все ингредиенты, кроме дрожжевого экстракта, готовили и использовали в качестве отрицательной контрольной среды. Все процедуры, связанные с бактериальным культивированием и мониторингом роста бактериальных клеток, проводили, как описано выше.
Анализ состава продукта
Количественный анализ состава полученного дрожжевого экстракта был проведен в эталонной лаборатории (лаборатория ASA, Тегеран, Иран). Общее количество белка, жира, золы, хлорида натрия, общего летучего азота (TVN), влаги и pH были анализируемыми химическими свойствами.
Общее количество белка, жира, золы, хлорида натрия, общего летучего азота (TVN), влаги и pH были анализируемыми химическими свойствами.
Статистический анализ
Все статистические анализы для сравнения роста бактерий в бульонных средах LB, приготовленных с использованием различных дрожжевых экстрактов, проводились с использованием t-критерия, реализованного в программе SPSS (версия 21.0). Значение p <0,05 считалось статистически значимым.
Результаты
Производство дрожжевого экстракта
В настоящей работе для приготовления дрожжевого экстракта использовали пекарские дрожжи ( Saccharomyces cerevisiae ) . Водную суспензию дрожжей готовили с последующим автоклавированием и центрифугированием для получения растворимой фракции. Эти этапы (центрифугирование и автоклавирование) повторяли еще раз для полного удаления клеточного дебриса.Супернатант наносили на распылительную сушилку для получения порошкообразного дрожжевого экстракта.
Оценка роста бактериальных клеток в твердых и жидких средах
E. coli DH5α и Staphylococcus aureus , как представители грамотрицательных и грамположительных типов бактерий соответственно, использовали для систематического определения роста бактерий как в твердой, так и в жидкой среде, приготовленной из полученного дрожжевого экстракта. Результат показал, что обе бактерии могут расти в твердой среде, содержащей полученный дрожжевой экстракт в качестве единственного источника питательной поддержки.. показаны колонии E. coli DH5α и Staphylococcus aureus, соответственно. На контрольных средах для обеих бактерий (.) колоний не наблюдалось. . демонстрируют скорость роста E. coli DH5α и Staphylococcus aureus в жидкой бульонной среде, состоящей из полученного дрожжевого экстракта в качестве единственного источника энергии, соответственно. Графики показывают, что качество дрожжевого экстракта, полученного в этой работе, достаточно высокое, чтобы его можно было использовать в качестве единственного источника питания для роста бактериальных клеток.
Выращивание бактерий на твердых средах, приготовленных из полученного дрожжевого экстракта в качестве единственного источника энергии для бактерий. (A) Колонии Staphylococcus au r eus в виде грамположительных бактерий на твердых средах, приготовленных из полученного дрожжевого экстракта. (B) Колонии E. coli DH5α в виде грамотрицательных бактерий на плотных средах, приготовленных из полученного дрожжевого экстракта. (C и D) Твердая среда без дрожжевого экстракта в качестве контроля для культивирования Staphylococcus au r eu и E. coli DH5α соответственно. Как видно на контрольных чашках, в среде отсутствуют колонии. Опыты проводились в трехкратной повторности.
(A) Модель роста E. coli DH5α как грамотрицательные бактерии (B) и Staphylococcus au r eus в виде грамположительных бактерий на жидких средах, приготовленных из полученного дрожжевого экстракта (в качестве единственного источника энергии) в различные промежутки времени. Как видно, количество бактерий увеличивается в течение 48 часов для обоих видов бактерий.Показаны средние ОП для трех отдельных экспериментов в разное время и соответствующее стандартное отклонение. Результаты показали, что оба типа бактерий были способны расти в среде LB, приготовленной из полученного дрожжевого экстракта, сравнимой с таковой в среде LB, приготовленной с использованием трех коммерческих дрожжевых экстрактов (. и .). Статистический анализ показал, что нет существенных различий между скоростями роста обоих типов бактерий в бульонной среде LB, приготовленной как с нашим продуктом дрожжевого экстракта, так и с тремя коммерческими.Сравнение скорости роста бактерий в среде LB, приготовленной с использованием полученного дрожжевого экстракта, со скоростью роста в контрольной среде, лишенной какого-либо дрожжевого экстракта, выявило значительную разницу для обоих типов бактерий. Разница наблюдалась через 4–48 ч после инокуляции E. coli и через 8–48 ч для Staphylococcus aureus (значение p <0,05) (.
Как видно, количество бактерий увеличивается в течение 48 часов для обоих видов бактерий.Показаны средние ОП для трех отдельных экспериментов в разное время и соответствующее стандартное отклонение. Результаты показали, что оба типа бактерий были способны расти в среде LB, приготовленной из полученного дрожжевого экстракта, сравнимой с таковой в среде LB, приготовленной с использованием трех коммерческих дрожжевых экстрактов (. и .). Статистический анализ показал, что нет существенных различий между скоростями роста обоих типов бактерий в бульонной среде LB, приготовленной как с нашим продуктом дрожжевого экстракта, так и с тремя коммерческими.Сравнение скорости роста бактерий в среде LB, приготовленной с использованием полученного дрожжевого экстракта, со скоростью роста в контрольной среде, лишенной какого-либо дрожжевого экстракта, выявило значительную разницу для обоих типов бактерий. Разница наблюдалась через 4–48 ч после инокуляции E. coli и через 8–48 ч для Staphylococcus aureus (значение p <0,05) (. и .).
и .).
A) Профиль роста бактериальных клеток для E. coli DH5α в виде грамотрицательных бактерий на бульонной среде Лурия Бертани, приготовленной из дрожжевого экстракта, полученного в этом исследовании, и коммерческих продуктов (Applichem, Merck и Sigma).В качестве контроля использовали среду без экстракта дрожжей. Для каждой точки данных были проведены тройные определения. Для ясности стандартные отклонения показаны только для среды, приготовленной из нашего дрожжевого экстракта, а также для контрольной среды. (B) Гистограмма E. Рост coli DH5α в другой среде LB. Результаты показывают, что нет существенной разницы между скоростью роста бактерий в бульоне LB, дополненном полученным дрожжевым экстрактом, и в бульоне LB, содержащем три коммерческих экстракта дрожжей (значение p>0.05). Анализ показывает существенную разницу между скоростью роста E. coli DH5α на среде LB, приготовленной из дрожжевого экстракта нашего производства, и в контроле через 4, 8, 16, 24 и 48 ч инокуляции (значение p <0,05). Значимые различия отмечены звездочками (*).
Значимые различия отмечены звездочками (*).
(A) Профиль роста бактериальных клеток для Staphylococcus au r eus в виде грамположительных бактерий на бульонной среде Luria Bertani, приготовленной из экстракта дрожжей, полученного в этом исследовании, и коммерческих продуктов (Applichem, Merck и Sigma).В качестве контроля использовали среду без экстракта дрожжей. Для каждой точки данных были проведены тройные определения. Для ясности стандартные отклонения показаны только для среды, приготовленной из нашего дрожжевого экстракта, а также для контрольной среды. (B) Гистограмма Staphylococcus au r eus рост в другой среде LB. Результаты показывают, что нет существенной разницы между скоростью роста бактерий в бульоне LB, дополненном полученным дрожжевым экстрактом, и в бульоне LB, содержащем три коммерческих экстракта дрожжей (значение p>0.05). Анализ показывает достоверную разницу между скоростью роста стафилококка и au r eus на среде LB, приготовленной из дрожжевого экстракта нашего производства, и контроля через 8, 16, 24 и 48 ч после инокуляции (значение p <0,05). Значимые различия отмечены звездочками (*).
Значимые различия отмечены звездочками (*).
Анализ состава дрожжевого экстракта
Количественные анализы полученного порошка дрожжевого экстракта показали, что экстракт содержит: белок (30%), жир (0,42%), хлорид натрия (0,67%), зола (12,18%), общий летучий азот (9,2%) при влажности 4,72% и рН 6,29.
Дискуссия
Дрожжевой экстракт представляет собой продукт клеток дрожжей, содержащий аминокислоты, липиды, витамины, минералы и другие растворимые компоненты, имеющий множество применений в пищевой промышленности, а также в качестве источника питания для микробных культур в области исследований молекулярной биологии и ферментационной промышленности ( 20-22). Двумя распространенными подходами к производству дрожжевого экстракта являются автолиз и гидролиз, однако это не исчерпывающая классификация, и многие методы не подпадают под эту классификацию.Автолиз, естественное явление, происходящее после гибели клетки, представляет собой саморасщепление клеточных составляющих дрожжевой клетки под действием высвобождаемых эндогенных пищеварительных ферментов. Сообщалось о нескольких стратегиях улучшения процесса автолиза, таких как изменение температуры, pH и осмотического давления, облучение рентгеновскими лучами и механическое измельчение или использование хитозана, химических индукторов, таких как органические растворители и поваренная соль (23-26). Процесс автолиза связан с некоторыми недостатками, такими как низкий выход экстракции, сложность разделения твердой и жидкой фаз из-за риска микробного загрязнения в результате длительной инкубации.В методе гидролиза для разрушения содержимого клетки используются различные экзогенные ферменты, кислоты или щелочи (27-29). Применение экзогенных ферментов в процессе гидролиза удорожает производство, кроме того, использование кислот или щелочей в этом процессе усложнит процессы очистки.
Сообщалось о нескольких стратегиях улучшения процесса автолиза, таких как изменение температуры, pH и осмотического давления, облучение рентгеновскими лучами и механическое измельчение или использование хитозана, химических индукторов, таких как органические растворители и поваренная соль (23-26). Процесс автолиза связан с некоторыми недостатками, такими как низкий выход экстракции, сложность разделения твердой и жидкой фаз из-за риска микробного загрязнения в результате длительной инкубации.В методе гидролиза для разрушения содержимого клетки используются различные экзогенные ферменты, кислоты или щелочи (27-29). Применение экзогенных ферментов в процессе гидролиза удорожает производство, кроме того, использование кислот или щелочей в этом процессе усложнит процессы очистки.
Исследования показывают, что в некоторых протоколах использовались различные механические процедуры для улучшения процессов авто- или гидролиза, но они не использовались отдельно для производства дрожжевого экстракта (30-31). В текущей работе мы разработали быстрый механический метод получения дрожжевого экстракта из пекарских дрожжей ( Saccharomyces cerevisiae ) для использования в качестве питательного агента в бактериальных культуральных средах. В этом методе к суспензии дрожжевых клеток применяли высокую температуру и давление с последующим быстрым охлаждением. Он вызывает потерю целостности клеточной мембраны, вызывая шок у дрожжевых клеток, что нельзя рассматривать ни как метод, основанный на автолизе, ни на гидролизе. В дальнейшем растворимую фракцию экстракта подвергали распылительной сушке для получения дрожжевого экстракта в виде порошка, более пригодного для хранения.Качество полученного дрожжевого экстракта было очень многообещающим, о чем можно было судить по характеру роста бактериальных клеток в среде, приготовленной из этого продукта. Важно отметить, что полученный дрожжевой экстракт мог использоваться бактериями в качестве единственного источника энергии в бактериальных твердых и жидких средах (.
В текущей работе мы разработали быстрый механический метод получения дрожжевого экстракта из пекарских дрожжей ( Saccharomyces cerevisiae ) для использования в качестве питательного агента в бактериальных культуральных средах. В этом методе к суспензии дрожжевых клеток применяли высокую температуру и давление с последующим быстрым охлаждением. Он вызывает потерю целостности клеточной мембраны, вызывая шок у дрожжевых клеток, что нельзя рассматривать ни как метод, основанный на автолизе, ни на гидролизе. В дальнейшем растворимую фракцию экстракта подвергали распылительной сушке для получения дрожжевого экстракта в виде порошка, более пригодного для хранения.Качество полученного дрожжевого экстракта было очень многообещающим, о чем можно было судить по характеру роста бактериальных клеток в среде, приготовленной из этого продукта. Важно отметить, что полученный дрожжевой экстракт мог использоваться бактериями в качестве единственного источника энергии в бактериальных твердых и жидких средах (. и .). Полученный дрожжевой экстракт сравним с тремя коммерческими дрожжевыми экстрактами с точки зрения свойств роста бактерий в среде LB ( и ). Преимущества разработанного нами способа производства дрожжевого экстракта по сравнению с существующими протоколами заключаются в следующем:
и .). Полученный дрожжевой экстракт сравним с тремя коммерческими дрожжевыми экстрактами с точки зрения свойств роста бактерий в среде LB ( и ). Преимущества разработанного нами способа производства дрожжевого экстракта по сравнению с существующими протоколами заключаются в следующем:
i) В процессе экстракции не использовались химические вещества, такие как кислоты, щелочи или соли, что, в свою очередь, устраняет сложности в последующих процессах из-за удаления добавленных реагентов и снижает стоимость производства.
ii) В процессе экстракции фермент не использовался, поэтому конечная стоимость производства будет снижена.
iii) Количество необходимых шагов в процессе экстракции было уменьшено, что ускорило производство экстракции дрожжей по сравнению с другими доступными утомительными и трудоемкими методами.
Заключение
Таким образом, мы разработали простой, быстрый и экономичный метод получения дрожжевого экстракта из пекарских дрожжей ( Saccharomyces cerevisiae) . Этот метод можно использовать в исследовательских лабораториях для снижения затрат на исследования и масштабировать для производства больших количеств для промышленных применений, где необходимо культивирование микробов.
Этот метод можно использовать в исследовательских лабораториях для снижения затрат на исследования и масштабировать для производства больших количеств для промышленных применений, где необходимо культивирование микробов.
Конфликт интересов
У авторов нет конфликта интересов, о котором следует заявить.
Ссылки
1. Mensour N, Margaritis A, Briens C, Pilkington H, Russell I. Применение иммобилизованных дрожжевых клеток в пивоваренной промышленности. прог. Биотехнолог. 1996; 11: 661–71. [Google Академия]2. Флот ГХ.Дрожжи в пищевых продуктах и напитках влияют на качество и безопасность продуктов. Курс. мнение Биотехнолог. 2007; 18:170–5. [PubMed] [Google Scholar]3. Маккар Р.С., ДиНово А.А., Вестуотер С., Шофилд Д.А. Ферментативная биоремедиация фосфорорганических соединений с использованием стабильных дрожжевых биокатализаторов. Дж. Биоремед. Биодег. 2013;4:2. [Google Академия]4. Дато Л., Брандуарди П., Пассолунги С., Каттанео Д., Рибольди Л., Фраскотти Г., Валли М. , Порро Д. Достижения в области молекулярных инструментов для использования Zygosaccharomyces bailii в качестве хозяина для биотехнологических производств и создания первого ауксотрофного мутанта.FEMS Yeast Res. 2010; 10:894–908. [PubMed] [Google Scholar]5. Делнери Д. Технология штрих-кода в применении дрожжей к фармакогеномике. FEMS Yeast Res. 2010;10:1083–9. [PubMed] [Google Scholar]6. Салари Р., Раджаби О., Хашьярманеш З., Фатхи Наджафи М., Фазли Баззаз Б.С. Характеристика инкапсулированного берберина в дрожжевых клетках Saccharomyces cerevisiae. Иран Дж. Фарм. Рез. 2015;14:1247–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]7. Криворучко А., Сиверс В., Нильсен Дж. Возможности метаболической инженерии дрожжей: уроки синтетической биологии.Биотехнолог. Дж. 2011; 6: 262–76. [PubMed] [Google Scholar]8. де Йонг Б., Сиверс В., Нильсен Дж. Системная биология дрожжей. благоприятные технологии для разработки клеточных фабрик для производства передового биотоплива. Курс. мнение Биотехнолог.
, Порро Д. Достижения в области молекулярных инструментов для использования Zygosaccharomyces bailii в качестве хозяина для биотехнологических производств и создания первого ауксотрофного мутанта.FEMS Yeast Res. 2010; 10:894–908. [PubMed] [Google Scholar]5. Делнери Д. Технология штрих-кода в применении дрожжей к фармакогеномике. FEMS Yeast Res. 2010;10:1083–9. [PubMed] [Google Scholar]6. Салари Р., Раджаби О., Хашьярманеш З., Фатхи Наджафи М., Фазли Баззаз Б.С. Характеристика инкапсулированного берберина в дрожжевых клетках Saccharomyces cerevisiae. Иран Дж. Фарм. Рез. 2015;14:1247–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]7. Криворучко А., Сиверс В., Нильсен Дж. Возможности метаболической инженерии дрожжей: уроки синтетической биологии.Биотехнолог. Дж. 2011; 6: 262–76. [PubMed] [Google Scholar]8. де Йонг Б., Сиверс В., Нильсен Дж. Системная биология дрожжей. благоприятные технологии для разработки клеточных фабрик для производства передового биотоплива. Курс. мнение Биотехнолог. 2012; 23: 624–30. [PubMed] [Google Scholar]9. Ferreira I, Pinho O, Vieira E, Tavarela J. Дрожжевая биомасса Saccharomyces Brewer: характеристики и потенциальные применения. Тенденции. Пищевая наука. Технол. 2010;21:77–84. [Google Академия] 10. Че ХДж, Чжу Х, Ин МДж. Использование клеток пивных дрожжей для производства пищевого дрожжевого экстракта. Часть 1: влияние различных ферментных обработок на восстановление твердого вещества и белка и вкусовые характеристики.Биоресурс. Технол. 2001; 76: 253–8. [PubMed] [Google Scholar] 11. Годро Х., Ренар Н., Шампань С., Хорн Д.В. Оценка смесей дрожжевого и картофельного экстрактов в питательной среде для производства биомассы молочнокислых культур. Может. Дж. Микробиол. 2002; 48: 626–34. [PubMed] [Google Scholar] 12. Чжан Дж., Редди Дж., Бакленд Б., Гришам Р. На пути к последовательной и продуктивной комплексной среде для исследований промышленной ферментации дрожжевого экстракта для процесса ферментации рекомбинантных дрожжей. Биотехнолог. биоинж.
2012; 23: 624–30. [PubMed] [Google Scholar]9. Ferreira I, Pinho O, Vieira E, Tavarela J. Дрожжевая биомасса Saccharomyces Brewer: характеристики и потенциальные применения. Тенденции. Пищевая наука. Технол. 2010;21:77–84. [Google Академия] 10. Че ХДж, Чжу Х, Ин МДж. Использование клеток пивных дрожжей для производства пищевого дрожжевого экстракта. Часть 1: влияние различных ферментных обработок на восстановление твердого вещества и белка и вкусовые характеристики.Биоресурс. Технол. 2001; 76: 253–8. [PubMed] [Google Scholar] 11. Годро Х., Ренар Н., Шампань С., Хорн Д.В. Оценка смесей дрожжевого и картофельного экстрактов в питательной среде для производства биомассы молочнокислых культур. Может. Дж. Микробиол. 2002; 48: 626–34. [PubMed] [Google Scholar] 12. Чжан Дж., Редди Дж., Бакленд Б., Гришам Р. На пути к последовательной и продуктивной комплексной среде для исследований промышленной ферментации дрожжевого экстракта для процесса ферментации рекомбинантных дрожжей. Биотехнолог. биоинж. 2003; 82: 640–52.[PubMed] [Google Scholar] 13. Акопян Л., Габриелян Л., Трчунян А. Дрожжевой экстракт как эффективный источник азота, стимулирующий рост клеток и усиливающий фотопродукцию водорода штаммами Rhodobacter sphaeroides из минеральных источников. Междунар. Дж. Водородная энергия. 2012; 37: 6519–26. [Google Академия] 14. Li X, Li Z, Zheng J, Shi Z, Li L. Экстракт дрожжей способствует фазовому сдвигу ферментации биобутанола Clostridium acetobutylicum ATCC824 с использованием маниоки в качестве субстрата. Биоресурс. Технол. 2012; 125:43–51. [PubMed] [Google Scholar] 15.Кадо Х., Шибата Т., Кобаяши Ф., Кубота М. Способ производства дрожжевого экстракта. Патент WO. 1998 1 998 046 089. [Google Академия] 16. Revillion JP, Brandelli A, Ayub MAZ. Производство дрожжевого экстракта из сыворотки с использованием Kluyveromyces marxianus. Браз. Арка биол. Технол. 2003;46:121–8. [Google Академия] 17. Милич Т.В., Ракин М., Шилер-Маринкович С. Использование пекарских дрожжей (Saccharomyces cerevisiae) для производства дрожжевого экстракта: влияние различных ферментных обработок на восстановление твердых веществ, белков и углеводов.
2003; 82: 640–52.[PubMed] [Google Scholar] 13. Акопян Л., Габриелян Л., Трчунян А. Дрожжевой экстракт как эффективный источник азота, стимулирующий рост клеток и усиливающий фотопродукцию водорода штаммами Rhodobacter sphaeroides из минеральных источников. Междунар. Дж. Водородная энергия. 2012; 37: 6519–26. [Google Академия] 14. Li X, Li Z, Zheng J, Shi Z, Li L. Экстракт дрожжей способствует фазовому сдвигу ферментации биобутанола Clostridium acetobutylicum ATCC824 с использованием маниоки в качестве субстрата. Биоресурс. Технол. 2012; 125:43–51. [PubMed] [Google Scholar] 15.Кадо Х., Шибата Т., Кобаяши Ф., Кубота М. Способ производства дрожжевого экстракта. Патент WO. 1998 1 998 046 089. [Google Академия] 16. Revillion JP, Brandelli A, Ayub MAZ. Производство дрожжевого экстракта из сыворотки с использованием Kluyveromyces marxianus. Браз. Арка биол. Технол. 2003;46:121–8. [Google Академия] 17. Милич Т.В., Ракин М., Шилер-Маринкович С. Использование пекарских дрожжей (Saccharomyces cerevisiae) для производства дрожжевого экстракта: влияние различных ферментных обработок на восстановление твердых веществ, белков и углеводов.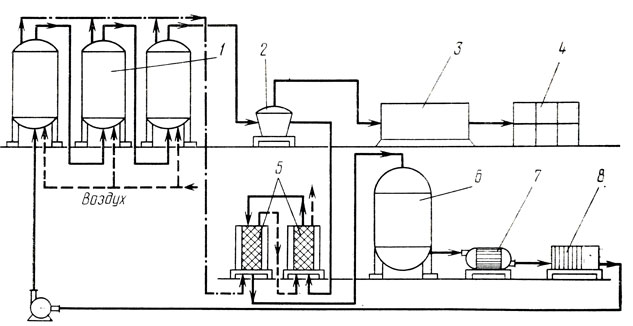 Ж. Серб. хим. соц. 2007; 72: 451–7. [Google Академия] 18. Хачия Т., Такашима Х., Танекава Т. Производство дрожжевого экстракта, содержащего ароматизатор. патент США. 1981 г. 4 303 680 человек. [Google Академия] 19. Potman RP, Wesdorp J. Способ приготовления дрожжевого экстракта, указанный дрожжевой экстракт, его применение в качестве пищевого ароматизатора и пищевая композиция, содержащая дрожжевой экстракт. Патент США. 1994 г. 5 288 509 человек. [Google Академия] 20. York S, Ingram L. Производство этанола рекомбинантной Escherichia coli KO11 с использованием сырого автолизата дрожжей в качестве питательной добавки.Биотехнолог. лат. 1996; 18: 683–8. [Google Академия] 21. Lo Y-M, Yang ST, Min DB. Влияние дрожжевого экстракта и глюкозы на продукцию ксантана и рост клеток в периодической культуре Xanthomonas campestris. заявл. микробиол. Биотехнолог. 1997; 47: 689–94. [Google Академия] 22. Ямал Г., Шармила П., Рао К., Пардха-Сарадхи П. Дрожжевой экстракт, маннитоловая среда и ее компоненты способствуют синтезу наночастиц золота.
Ж. Серб. хим. соц. 2007; 72: 451–7. [Google Академия] 18. Хачия Т., Такашима Х., Танекава Т. Производство дрожжевого экстракта, содержащего ароматизатор. патент США. 1981 г. 4 303 680 человек. [Google Академия] 19. Potman RP, Wesdorp J. Способ приготовления дрожжевого экстракта, указанный дрожжевой экстракт, его применение в качестве пищевого ароматизатора и пищевая композиция, содержащая дрожжевой экстракт. Патент США. 1994 г. 5 288 509 человек. [Google Академия] 20. York S, Ingram L. Производство этанола рекомбинантной Escherichia coli KO11 с использованием сырого автолизата дрожжей в качестве питательной добавки.Биотехнолог. лат. 1996; 18: 683–8. [Google Академия] 21. Lo Y-M, Yang ST, Min DB. Влияние дрожжевого экстракта и глюкозы на продукцию ксантана и рост клеток в периодической культуре Xanthomonas campestris. заявл. микробиол. Биотехнолог. 1997; 47: 689–94. [Google Академия] 22. Ямал Г., Шармила П., Рао К., Пардха-Сарадхи П. Дрожжевой экстракт, маннитоловая среда и ее компоненты способствуют синтезу наночастиц золота. Процесс биохим. 2013;48:532–538. [Google Академия] 23. Ноордам Б. Способ производства дрожжевых экстрактов с низкой мутностью.Патент США. 2013 20 130 316 047. [Google Академия] 24. Бабаян Т., Безруков М. Автолиз в дрожжах. Акта Биотехнолог. 1985; 5: 129–36. [Google Академия] 25. Канегае Ю., Сугияма Ю., Минами К. Способ получения дрожжевого экстракта. Патент на ЭП. 1993 г. 0 249 435. [Google Академия] 26. Origane A, Sato T. Производство дрожжевого экстракта. Патент на ЭП. 1994 г. 0 466 922. [Google Академия] 27. Калум Л. Способ получения дрожжевого экстракта. Патент на ЭП. 2009 2 097 510. [Google Академия] 28. Hyoeky G, Sarkki M-l, Tylli M. Способ получения дрожжевого экстракта, пригодного для использования в пищевых продуктах, при котором из экстракта были удалены нежелательные ароматизаторы.Патент на ЭП. 1998 г. 0 871 374. [Google Академия] 29. Конвей Дж., Годро Х., Шампань С.П. Влияние добавления протеаз и глюканаз при автолизе дрожжей на продукцию и свойства дрожжевых экстрактов. Может.
Процесс биохим. 2013;48:532–538. [Google Академия] 23. Ноордам Б. Способ производства дрожжевых экстрактов с низкой мутностью.Патент США. 2013 20 130 316 047. [Google Академия] 24. Бабаян Т., Безруков М. Автолиз в дрожжах. Акта Биотехнолог. 1985; 5: 129–36. [Google Академия] 25. Канегае Ю., Сугияма Ю., Минами К. Способ получения дрожжевого экстракта. Патент на ЭП. 1993 г. 0 249 435. [Google Академия] 26. Origane A, Sato T. Производство дрожжевого экстракта. Патент на ЭП. 1994 г. 0 466 922. [Google Академия] 27. Калум Л. Способ получения дрожжевого экстракта. Патент на ЭП. 2009 2 097 510. [Google Академия] 28. Hyoeky G, Sarkki M-l, Tylli M. Способ получения дрожжевого экстракта, пригодного для использования в пищевых продуктах, при котором из экстракта были удалены нежелательные ароматизаторы.Патент на ЭП. 1998 г. 0 871 374. [Google Академия] 29. Конвей Дж., Годро Х., Шампань С.П. Влияние добавления протеаз и глюканаз при автолизе дрожжей на продукцию и свойства дрожжевых экстрактов. Может. Дж. Микробиол. 2001; 47:18–24. [PubMed] [Google Scholar] 30. Moench S, Stute R. Процесс производства дрожжевых экстрактов. Патент на ЭП. 2002 г. 1 199 353 человека. [Google Академия] 31. Харада С., Ито Дж., Яно М., Аояги Ю., Маекава Х. Экстракт дрожжей и способ его приготовления. Патент на ЭП. 1989 0 299 078.[Google Scholar]
Дж. Микробиол. 2001; 47:18–24. [PubMed] [Google Scholar] 30. Moench S, Stute R. Процесс производства дрожжевых экстрактов. Патент на ЭП. 2002 г. 1 199 353 человека. [Google Академия] 31. Харада С., Ито Дж., Яно М., Аояги Ю., Маекава Х. Экстракт дрожжей и способ его приготовления. Патент на ЭП. 1989 0 299 078.[Google Scholar]новый подход к стратегии питания с ограничением содержания глюкозы
Braz J Microbiol. 2013; 44(2): 551–558.
Érika Durão Vieira
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Campinas, SP, Бразилия.
Мария да Граса Ступьелло Андриетта
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Бразилия.
Сильвио Роберто Андриетта
2 Centro Pluridisciplinar de Pesquisas Quimicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Бразилия.
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Campinas, SP, Бразилия.
2 Centro Pluridisciplinar de Pesquisas Quimicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Бразилия.
Отправить корреспонденцию Э. Д. Виейре. Школа химического машиностроения, Кампинасский университет, Cidade Universitária «Zeferino Vaz», C.P. 6066, 13083-970 Кампинас, SP, Бразилия. Электронная почта: moc.liamg@vdakire.Поступила в редакцию 27 июня 2011 г.; Принято 10 сентября 2012 г.
Авторское право © 2013, Sociedade Brasileira de MicrobiologiaВсе содержимое журнала, если не указано иное, распространяется под лицензией Creative Commons License CC BY-NC.
Эта статья была процитирована другими статьями в PMC.Abstract
Целью данной работы было экспериментальное осуществление простой стратегии кормления с ограничением содержания глюкозы для производства дрожжевой биомассы в реакторе с барботажной колонной на основе табличного симулятора, подходящего для промышленного применения. В процессе производства биомассы с использованием штаммов Saccharomyces cerevisiae одним из ограничений является сильная склонность этих видов к анаэробному метаболизму сахаров из-за катаболитной репрессии, что приводит к низким значениям выхода биомассы на субстрате. Обычной стратегией контроля этой метаболической тенденции является использование периодического процесса с подпиткой, при котором источник сахара подается постепенно, а общая концентрация сахара в бульоне поддерживается ниже определенного значения. Симулятор, представленный в этой работе, был разработан для управления подачей мелассы на основе простой теоретической модели, в которой учитывались потребности в питательных веществах для роста клеток дрожжей и два входных данных: теоретическая удельная скорость роста и начальная биомасса клеток. В экспериментальном анализе использовали коммерческий штамм пекарских дрожжей и патоку в качестве источника сахара.Экспериментальные результаты показали общий выход биомассы на субстрате 0,33, увеличение биомассы в 6,4 раза и удельную скорость роста 0,165 ч -1 в отличие от прогнозируемого значения 0,180 ч-1 на втором этапе моделирования.
Обычной стратегией контроля этой метаболической тенденции является использование периодического процесса с подпиткой, при котором источник сахара подается постепенно, а общая концентрация сахара в бульоне поддерживается ниже определенного значения. Симулятор, представленный в этой работе, был разработан для управления подачей мелассы на основе простой теоретической модели, в которой учитывались потребности в питательных веществах для роста клеток дрожжей и два входных данных: теоретическая удельная скорость роста и начальная биомасса клеток. В экспериментальном анализе использовали коммерческий штамм пекарских дрожжей и патоку в качестве источника сахара.Экспериментальные результаты показали общий выход биомассы на субстрате 0,33, увеличение биомассы в 6,4 раза и удельную скорость роста 0,165 ч -1 в отличие от прогнозируемого значения 0,180 ч-1 на втором этапе моделирования.
Ключевые слова: дрожжи, биомасса, подпитка, моделирование процесса, Saccharomyces cerevisiae
Введение
Большие количества. Биомасса дрожжей широко используется в качестве добавки человеческого или животного белка в кормах для животных или в питании человека (Halasz and Lasztity, 1991). Обычные штаммы, используемые в качестве источника одноклеточного белка, включают штаммы Saccharomyces cerevisiae и Candida utilis . Типичные продукты микробной биомассы включают пекарские дрожжи и дрожжевые экстракты, где штаммов Saccharomyces cerevisiae являются хозяевами продукции гетерологичных белков (Beudeker et al. , 1990; Hensing et al., 1995).
Биомасса дрожжей широко используется в качестве добавки человеческого или животного белка в кормах для животных или в питании человека (Halasz and Lasztity, 1991). Обычные штаммы, используемые в качестве источника одноклеточного белка, включают штаммы Saccharomyces cerevisiae и Candida utilis . Типичные продукты микробной биомассы включают пекарские дрожжи и дрожжевые экстракты, где штаммов Saccharomyces cerevisiae являются хозяевами продукции гетерологичных белков (Beudeker et al. , 1990; Hensing et al., 1995).
В основном, концепция промышленного процесса основана на размножении клеток из скошенных культур агара в большие биореакторы, увеличивая объем на каждой стадии размножения до конечного объема биореактора (Rose, 1979; Burrows, 1979; EPA, 1995; Rendez-Gil, Sanz and Priteo, 1999; Di Serio и др. , 2001; Di Serio, Tesser and Santacesaria, 2001). Однако, помимо этой простой концепции, промышленное производство направлено на эффективное преобразование сахарного сырья в биомассу дрожжей, главным образом на более поздних стадиях, когда объем биомассы велик. Эффективное преобразование сахара в дрожжевой белок требует, чтобы производство анаэробных метаболитов, таких как этанол и ацетальдегид (Bauer et al. , 1999), было сведено к минимуму, т.е. , чтобы метаболизм сахара был отклонен в сторону окислительного пути для достижения максимального выхода энергии АТФ. и образование биомассы (Van Hoek, Van Dijken and Pronk, 1998). Более того, токсичными являются продукты брожения, такие как этанол и, в частности, ацетальдегид. Эта проблема становится особенно актуальной при культивировании при высоких плотностях биомассы (Hensing et al., 1995; ван Дейкен, Веустуис и Пронк, 1993).
Эффективное преобразование сахара в дрожжевой белок требует, чтобы производство анаэробных метаболитов, таких как этанол и ацетальдегид (Bauer et al. , 1999), было сведено к минимуму, т.е. , чтобы метаболизм сахара был отклонен в сторону окислительного пути для достижения максимального выхода энергии АТФ. и образование биомассы (Van Hoek, Van Dijken and Pronk, 1998). Более того, токсичными являются продукты брожения, такие как этанол и, в частности, ацетальдегид. Эта проблема становится особенно актуальной при культивировании при высоких плотностях биомассы (Hensing et al., 1995; ван Дейкен, Веустуис и Пронк, 1993).
Общеизвестно, что видов Saccharomyces cerevisiae имеют тенденцию к гликолитическому метаболизму глюкозы при избытке глюкозы даже в полностью аэробных условиях с образованием этанола, явление, известное как эффект Крэбтри (Käppeli, 1986; Sonnleitner and Käppeli, 1986; Verduyn, 1991; Dynesen). , 1998). Кроме того, было показано, что не только глюкоза, но и фруктоза запускают катаболитную репрессию у штаммов Saccharomyces cerevisiae (Dynesen, 1998). Эта катаболитная репрессия приводит к низкому выходу биомассы при культивировании Saccharomyces cerevisiae в периодических культурах и отрицательно влияет на выход биомассы из-за низкого выхода АТФ в результате спиртового брожения. Несмотря на это, образование биомассы может быть достигнуто за счет многочисленных метаболических путей (Frick and Whitmann, 2005), а выход биомассы на субстрате может достигать значений до 50% при чисто окислительном росте (Akinyemi, Betiku and Solomon, 2005).
Эта катаболитная репрессия приводит к низкому выходу биомассы при культивировании Saccharomyces cerevisiae в периодических культурах и отрицательно влияет на выход биомассы из-за низкого выхода АТФ в результате спиртового брожения. Несмотря на это, образование биомассы может быть достигнуто за счет многочисленных метаболических путей (Frick and Whitmann, 2005), а выход биомассы на субстрате может достигать значений до 50% при чисто окислительном росте (Akinyemi, Betiku and Solomon, 2005).
Для преодоления этих ограничений производства биомассы дрожжей большое значение имеют две важные переменные: скорость переноса кислорода и концентрация глюкозы в бульоне.В гетерогенных газожидкостных реакциях т.е. , при аэробном брожении жидкая фаза регулирует процессы массообмена за счет относительной нерастворимости газов. Это ограничение сводится к минимуму за счет использования реакторов с барботажной колонной из-за хорошей передачи кислорода при низкой стоимости эксплуатации по сравнению с реакторами с мешалкой (Kantarcia, Borakb and Ulgen, 2005). Минимальная концентрация сахара в бульоне может быть достигнута при использовании периодического процесса с подпиткой. Эта концепция процесса является современной в промышленном масштабе и обеспечивает хорошие выходы биомассы при использовании соответствующей стратегии управления процессом.Традиционно в промышленном производстве подача мелассы или другого сырья следует стратегии, построенной на основе заводских исторических данных, и поэтому она характерна для определенного штамма и других условий процесса. В настоящее время не только по экономическим причинам, но и из-за экологической политики некоторые отрасли инвестируют в новые стратегии управления технологическими процессами, чтобы избежать выбросов токсичных загрязнителей (EPA, 1995). В научной литературе можно найти множество статей о производстве пекарских дрожжей, посвященных моделированию роста дрожжей и направленным на достижение различных целей, таких как продуктивность, выход и качество дрожжей, а также о новых и надежных онлайн-датчиках (Reyman, 1992; Rigbom, Rothberg and Saxen, 1996 г.
Минимальная концентрация сахара в бульоне может быть достигнута при использовании периодического процесса с подпиткой. Эта концепция процесса является современной в промышленном масштабе и обеспечивает хорошие выходы биомассы при использовании соответствующей стратегии управления процессом.Традиционно в промышленном производстве подача мелассы или другого сырья следует стратегии, построенной на основе заводских исторических данных, и поэтому она характерна для определенного штамма и других условий процесса. В настоящее время не только по экономическим причинам, но и из-за экологической политики некоторые отрасли инвестируют в новые стратегии управления технологическими процессами, чтобы избежать выбросов токсичных загрязнителей (EPA, 1995). В научной литературе можно найти множество статей о производстве пекарских дрожжей, посвященных моделированию роста дрожжей и направленным на достижение различных целей, таких как продуктивность, выход и качество дрожжей, а также о новых и надежных онлайн-датчиках (Reyman, 1992; Rigbom, Rothberg and Saxen, 1996 г. ; Rendez-Gil, Sanz and Priteo, 1999 г.; Jones and Kompala, 1999 г.; Di Serio и др., 2001; Ди Серио, Тессер и Сантачесария, 2001 г .; Солей, 2005). Однако существует несколько простых теоретических моделей производства биомассы дрожжей, которые могли бы подойти для любого штамма и процесса и могли бы быть применимы в промышленных масштабах.
; Rendez-Gil, Sanz and Priteo, 1999 г.; Jones and Kompala, 1999 г.; Di Serio и др., 2001; Ди Серио, Тессер и Сантачесария, 2001 г .; Солей, 2005). Однако существует несколько простых теоретических моделей производства биомассы дрожжей, которые могли бы подойти для любого штамма и процесса и могли бы быть применимы в промышленных масштабах.
Таким образом, целью настоящей работы было разработать и экспериментально реализовать простую теоретическую модель роста дрожжей, основанную на нескольких параметрах, с целью достижения стратегии кормления с ограничением содержания глюкозы, применимой в промышленных масштабах. Для этой цели была разработана электронная таблица, в которой теоретическая модель могла предсказывать в каждый временной интервал потребность дрожжевой клетки в питании для роста на основе двух основных исходных данных: теоретической удельной скорости роста и начальной биомассы клетки.Модель была проверена в ходе лабораторного эксперимента. Производство биомассы осуществляли в 5-литровом реакторе с барботажной колонной с использованием имеющегося в продаже штамма пекарских дрожжей. Первые две стадии размножения дрожжевых клеток, характерные для промышленного процесса, были смоделированы экспериментально с использованием патоки сахарного тростника в качестве источника углерода.
Первые две стадии размножения дрожжевых клеток, характерные для промышленного процесса, были смоделированы экспериментально с использованием патоки сахарного тростника в качестве источника углерода.
Материалы и методы
Операционная система
Операционная система показана на . Реактор, использованный в этой работе, представлял собой цилиндрический акриловый сосуд на 5.Объем 5 литров с коническим дном. К концу конического дна присоединялась трубка диаметром 1 см для входа воздуха без какого-либо воздухораспределителя. В конструкцию были добавлены пять равномерно расположенных поперечных перегородок с 4 отверстиями для создания турбулентности и сдвига, которые могли бы разрушить пузырьки воздуха. Конструкция также включала небольшие выпускные трубки, через которые можно было подавать патоку, а клетки могли циркулировать через теплообменник со стеклянным змеевиком, соединенный с термостатической ванной с температурой 34 ° C. Аэрацию оценивали по шкале типичных промышленных условий: 0. 3 ввм для первой ступени и 1,3 ввм для второй ступени. Уменьшение масштаба основывалось на критерии геометрического подобия реакторов и одинакового коэффициента массообмена (k La1 = k La2 ) (Aiba, 1971). Это привело к 2,5 vvm (9 л/мин) для первой ступени и 1,3 vvm (приблизительно 30 л/мин) для второй ступени. Реактор предварительно промывали 5% раствором гидроксида натрия для предотвращения чрезмерного бактериального загрязнения.
3 ввм для первой ступени и 1,3 ввм для второй ступени. Уменьшение масштаба основывалось на критерии геометрического подобия реакторов и одинакового коэффициента массообмена (k La1 = k La2 ) (Aiba, 1971). Это привело к 2,5 vvm (9 л/мин) для первой ступени и 1,3 vvm (приблизительно 30 л/мин) для второй ступени. Реактор предварительно промывали 5% раствором гидроксида натрия для предотвращения чрезмерного бактериального загрязнения.
Операционная система: (1) акриловый сосуд, (2) колба с мелассой, (3) теплообменник со стеклянным змеевиком, (4) термостатическая ванна, (5) ротаметр, (6) перистальтические насосы Masterflex и (7) двузначные весы.
Микроорганизм
Микроорганизм, оцениваемый в этом анализе, представлял собой коммерческий штамм пекарских дрожжей Saccharomyces cerevisiae под названием Y167 из коллекции дрожжей CPQBA. Этот штамм был выбран из-за его известной характеристики высокой скорости роста клеток. Микроорганизм сохраняли в картофельно-декстрозном агаре (КДА), погруженном в минеральное масло, и хранили при 4°С. Размножение инициировали путем переноса сохраненного микроорганизма на свежий скошенный PDA, который инкубировали при 32 °C в течение 24 часов.
Размножение инициировали путем переноса сохраненного микроорганизма на свежий скошенный PDA, который инкубировали при 32 °C в течение 24 часов.
Инокулят
Используемый инокулят готовили в колбах Эрленмайера на 250 мл со 100 мл стерилизованной среды (15 мин при 121 °C), состоящей из: 150 г/л сахарозы, 6 г/л дрожжевого экстракта, 5 г/л фосфата калия одноосновный, 5 г/л хлорида аммония, 1 г/л сульфата магния и 1 г/л хлорида калия. Дрожжи, выращенные в скошенном ПДА в течение 24 ч при 32 °С, ресуспендировали в стерилизованной воде и инокулировали в концентрации 10% от общего объема ферментационной среды. Колбы инкубировали на шейкере в течение 24 ч при 32°С и 150 об/мин.
Кормовой субстрат
Источник углерода, использованный во всех анализах, получен из единственной партии мелассы сахарного тростника с бразильского сахарного завода. Этот образец патоки имел 80° Brix с общим содержанием сахара около 56% и был удобно разбавлен дистиллированной водой для использования в анализах. В качестве источника фосфора использовали одноосновный фосфат калия (KH 2 PO 4 ), а в качестве источника азота использовали хлорид аммония (NH 4 Cl). Другие витамины и питательные вещества уже присутствуют в достаточном количестве в патоке сахарного тростника, так что ферментационный бульон был обогащен только указанными солями, чтобы гарантировать поступление азота и фосфора.
В качестве источника фосфора использовали одноосновный фосфат калия (KH 2 PO 4 ), а в качестве источника азота использовали хлорид аммония (NH 4 Cl). Другие витамины и питательные вещества уже присутствуют в достаточном количестве в патоке сахарного тростника, так что ферментационный бульон был обогащен только указанными солями, чтобы гарантировать поступление азота и фосфора.
Первая стадия роста клеток
Реактор был заполнен 3,5 литрами разбавленной мелассы сахарного тростника с приблизительно 15° Brix, предварительно стерилизованной в течение 10 минут при 121 °C. Меласса была обогащена KH 2 PO 4 и NH 4 Cl, а pH был доведен до 4,5, что является оптимальным для большинства штаммов Saccharomyces cerevisiae (Rose, 1987). На табличном симуляторе рассчитывали необходимое количество сырой патоки и солей азота и фосфора.45 мл дрожжей, выращенных в колбе, инкубировали в реакторе. Эту первую стадию роста клеток проводили в течение 16 часов при уровне аэрации 9 л/мин. Эта стадия проводилась без периодического отбора проб и с избытком источника углерода один раз. Целью этой стадии является получение максимального увеличения биомассы в ущерб потере биомассы на выходе субстрата (оценка 0,22) и высокой продуктивности. Через 16 часов реактор опорожняли и промывали водой, а часть ферментационного бульона первой стадии использовали в качестве инокулята для второй стадии.В промышленном процессе происходит постепенное увеличение объема биореакторов, так что объем биореактора первой ступени составляет около 15–20% от объема биореактора второй ступени, и весь ферментационный бульон первой ступени переносится на вторую стадию. ступенчатый биореактор для продолжения размножения дрожжевой биомассы. Из-за отсутствия в лаборатории более крупного биореактора анализ второй стадии проводили в том же акриловом сосуде, что и первая стадия, и количестве ферментационного бульона с первой стадии, соответствующему 16% конечного рабочего объема (3.5 литров), использовали в качестве инокулята для второй стадии.
Эта стадия проводилась без периодического отбора проб и с избытком источника углерода один раз. Целью этой стадии является получение максимального увеличения биомассы в ущерб потере биомассы на выходе субстрата (оценка 0,22) и высокой продуктивности. Через 16 часов реактор опорожняли и промывали водой, а часть ферментационного бульона первой стадии использовали в качестве инокулята для второй стадии.В промышленном процессе происходит постепенное увеличение объема биореакторов, так что объем биореактора первой ступени составляет около 15–20% от объема биореактора второй ступени, и весь ферментационный бульон первой ступени переносится на вторую стадию. ступенчатый биореактор для продолжения размножения дрожжевой биомассы. Из-за отсутствия в лаборатории более крупного биореактора анализ второй стадии проводили в том же акриловом сосуде, что и первая стадия, и количестве ферментационного бульона с первой стадии, соответствующему 16% конечного рабочего объема (3.5 литров), использовали в качестве инокулята для второй стадии.
Вторая стадия роста клеток
Очищенный реактор заливали 2 литрами дистиллированной воды. Это количество было рассчитано на основе данных электронной таблицы для завершения конечного рабочего объема 3,5 литра. Эта операция добавления воды является обычной при промышленном производстве биомассы дрожжей, чтобы минимизировать концентрацию этанола, образующегося на первой стадии размножения, которая может ингибировать рост клеток на следующей стадии. Затем в реактор инокулировали 560 мл (16% 3.5 литров) ферментационного бульона с первой стадии, рН которого предварительно доводили до 4,5 с помощью 2 н. HCl. Второй этап выращивания клеток проводили в течение 12 часов при уровне аэрации 30 л/мин. Разбавленную мелассу (40° по шкале Брикса), предварительно стерилизованную в течение 10 мин при 121°С, постепенно подавали с помощью перистальтического насоса. Скорость подачи контролировали путем взвешивания колбы с патокой на двухзначных весах. Каждый час к ферментационному бульону добавляли определенную аликвоту 10% (вес/вес) одноосновного раствора фосфата калия и 10% (вес/вес) раствора хлорида аммония.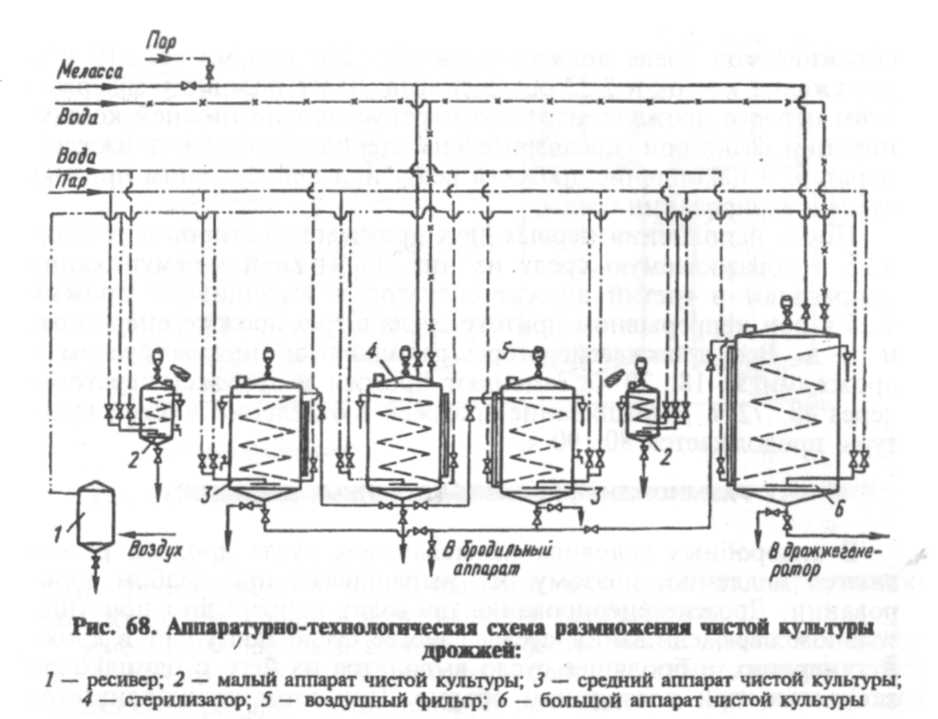 Массу патоки и аликвоты растворов азота и фосфора, подаваемые в каждый временной интервал, рассчитывали на основе симулятора электронных таблиц производства биомассы.
Массу патоки и аликвоты растворов азота и фосфора, подаваемые в каждый временной интервал, рассчитывали на основе симулятора электронных таблиц производства биомассы.
Отбор проб биореактора
На первом этапе отбирали две пробы по 10 мл в 0 ч и 16 ч, а на второй стадии отбирали по 10 мл пробы каждый час для измерения биомассы (стандартный метод для сухого клеточной массы) и анализы на фруктозу, глюкозу и сахарозу (ВЭЖХ). Образец объемом 10 мл центрифугировали при 4000 об/мин в течение 4 мин в градуированных центрифужных пробирках.Супернатант разбавляли для ВЭЖХ-анализа в хроматографической системе Dionex с колонкой CarboPac PA1 и импульсным амперометрическим детектированием. Объем влажных клеток использовали для оценки концентрации клеток в бульоне, учитывая, что масса сухих клеток (г) приблизительно равна 25% объема влажных клеток (мл). Центрифугированные клетки промывали дистиллированной водой и дважды центрифугировали после переноса на предварительно взвешенные чашки. Клетки высушивали при 60 ± 5 °С до постоянной массы.
Клетки высушивали при 60 ± 5 °С до постоянной массы.
Симулятор электронных таблиц производства биомассы
Электронная таблица была разработана для имитации роста дрожжевых клеток и прогнозирования их потребностей в питательных веществах в периодическом процессе с подпиткой при ограниченной концентрации глюкозы.Характер роста клеток задавали как экспоненциальный в соответствии с общим уравнением X=X 0 EXP(v 0 .t), где X обозначает микробную биомассу в момент времени t, X 0 микробную биомассу в момент времени t = 0, t время в часах (ч) и v 0 удельная скорость роста (ч -1 ). Увеличение биомассы за каждый часовой интервал можно рассчитать после ввода исходной клеточной массы (X 0 ) и ± te (μ̄). Потребности в питательных веществах (источник углерода, азота и фосфора) рассчитывались на основе (i) среднего содержания элементов в клетке (% вес./вес.) углерода, азота и фосфора (Atkinson and Mavituna, 1991; Lange and Heijnem, 2001) и ( ii) масса дрожжевых клеток в реакторе в каждый момент времени (X(t)).Считалось, что только 50% потребленного углерода трансформировалось в биомассу, т. е. , выход биомассы на субстрате (Y X/S ) равен 0,5. показывает основу электронных таблиц, реализованную в программном обеспечении Microsoft Excel. показаны определения переменных, используемых в симуляторе электронных таблиц.
Таблица 1
Основа симулятора электронных таблиц.
| CONIC | PRUMIAL | Символ | Unit | |
|---|---|---|---|---|
| H | — | |||
| 2 | ||||
2 | Масса | Х(т) | г | =X0*exp(μ¯*t) | |
| 3 | Масса углерода в ячейках во времени t | C(t) | г | = CF*X(t) |
| 4 | Масса азота в ячейках во времени t | N(t) | г | = NF*X(t) |
| 5 | Масса фосфора в клетках во времени t | P(t) | г | = PF*X(t) |
| 6 | Потребность в углероде | ΔC(t) | г | = C(t + 1) — C(t) |
| 7 | Общее снижение потребности в сахаре | ΔTRS(t) | г | = ΔC(t)/(H*Y X/S ) |
| 8 | Потребность в разбавленной патоке | ΔM(t) | г | = ΔTRS(t)*d/MP |
| 9 | Потребность в азоте | ΔN(t) | г | = N(t + 1) — N(t) |
| 10 | 10% NH 4 Аликвота раствора CL | ΔNS(t) | мл | = ΔN(t)*W/NFS |
| 11 | Потребность в фосфоре | ΔP(t) | г | = P(t + 1) — P(t) |
| 12 | 10% KH 2 PO 4 аликвота раствора | ΔPS(t) | мл = ΔP(t)*W/PFS |
Таблица 2
Определение переменных.
| Valuable | Value | Определение | Unit | |||
|---|---|---|---|---|---|---|
| x | Начальная клеточная масса | G | ||||
| μ̄ | для установки | Удельная скорость роста | ч −1 | |||
| FC | 0,47 | Массовая доля углерода в дрожжевой клетке | — | |||
| масса азота веса в дрожжевой ячейке | — | |||||
| PF | 0.0113 | 0.0113 | 0,0113 | |||
| y x / s | 0.5 | доходность биомассы на подложке | — | для установки | коэффициент разбавления патоки | — |
| MP | Чистота сахара мелассы (TRS на мелассу, г/г) | вес/вес | ||||
| NFS | 0.26 | азотный вес фракции в NH 4 CL | — | |||
| PFS | 0.23 | 0.23 | 2 Po 2 Po 4 | — | ||
| W | 10 | Концентрация соли | %масс./масс. |
Результаты
Расчетная таблица, использованная для оценки необходимого количества питательных веществ на первом этапе анализа, показана на . Необходимое количество сырой мелассы и солей азота и фосфора рассчитывали исходя из содержания биомассы в реакторе 70 г в конце первой стадии.Это соображение было сделано на основе оценки увеличения биомассы в 100 раз, с 0,7 г до 70 г общей биомассы, без учета модели экспоненциального роста. Расчетная электронная таблица, использованная во втором этапе анализа, показана на рис. Была принята удельная скорость роста 0,18 ч -1 и ожидаемая начальная масса клеток 7,0 г, рассчитанная по центрифугированному объему влажных клеток инокулята. Чистота мелассы составила 56%, как определено с помощью HPCL сахара (фруктоза, глюкоза и сахароза) и анализа по шкале Брикса.Объем дистиллированной воды, добавленной в реактор, рассчитывали путем вычитания объема питательных веществ, которые должны быть добавлены до конца 12 часов, и объема инокулята из общего рабочего объема реактора. Плотность разбавленной мелассы принималась равной 1,06 г/мл. Следует отметить, что конечный объем на втором этапе не достиг ожидаемых 3,5 л из-за потери отогнанной при аэрации воды. Конечный объем составлял приблизительно 3 литра, и все данные о концентрации были скорректированы на основе этого эффекта.Таблица 3
Таблица 4
Второй этап Электронные таблицы данных, построенные со следующими входными переменными: x 0 = 7.0 г / л, μ̄ = 0,18 h -1 , MP = 0,56 и d = 2.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| x (t) | c (t) | n (t) | p (t) | Δc (t) | Δtrs (t) | Δns | Δns | Δns | Δp | Δp | (g) | (g) | (g) | (g) | (г) | (г) | (г) | (г) | (мл) | (г) | (мл) |
| 0 | 7.0 | 3,29 | 0,60 | 0,08 | 0,65 | 3,2 | 11,6 | 0,12 | 4,5 | 0,02 | 0,7 | |
| 8,4 | 3,94 | 0,71 | 0,09 | 0,78 | 3.9 | 13.9 | 0,14 | 5.4 | 0.02 | 0.02 | ||
| 2 | 10.0 | 4,72 | 0,85 | 0.85 | 0,11 | 0.93 | 4,7 | 16,6 | 0,17 | 6,4 | 0,02 | 1,0 |
| 3 | 12,0 | 5,65 | 1,02 | 0,14 | 1,11 | 5,6 | 19,9 | 0,20 | 7.7 | 0.03 | 1.2 | |
| 4 | 14.49 | 6.76 | 1.22 | 0,16 | 1,33 | 1.33 | 6.7 | 23.8 | 0.24 | 9,2 | 0,03 | 1,4 |
| 17,2 | 8,09 | 1,46 | 0,19 | 1,60 | 8,0 | 28,5 | 0,29 | 11,0 | 0,04 | 1,7 | ||
| 6 | ||||||||||||
| 6 | 20.6 | 9.69 | 0.23 | 0.23 | 1.91 | 9.6 | 9.6 | 34.1 | 0.35 | 13.2 | 0,05 | 2.0 |
| 7 | 24,7 | 11,60 | 2,10 | 0,28 | 2,29 | 11,4 | 40,8 | 0,41 | 15,8 | 0,05 | 2,4 | |
| 8 | 29,5 | 13.89 | 2.51 | 0.33 | 2,74 | 13.7 | 48.9 | 0.50 | 18.9 | 0,07 | 0,07 | 2,9 |
| 9 | 35.4 | 16,62 | 3,01 | 0,40 | 3,28 | 16,4 | 58,5 | 0,59 | 22,6 | 0,08 | 3,5 | |
| 42,3 | 19,90 | 3,60 | 0,48 | 3.93 | 19.6 | 70.1 | 0,71 | 27.1 | 0.09 | 4.1 | ||
| 50.7 | 50.7 | 23.83 | 4,31 | 4,31 | 0.57 | 4,70 | 23,5 | 83,9 | 0,85 | 32,5 | 0,11 | 5,0 |
| 12 | 60,7 | 28,53 | 5,16 | 0,69 | — | — | — | — | — | — | — | — |
| — | — | — | — | — | 126.19 | 450.68 | 450,69 | 174.3 | 0,61 | 26,7 | ||
| Исходные данные | ||||||||||||
| Объем добавленных питательных веществ (мл) | 1186 | |||||||||||
| инокулята объем (мл) | 560 | |||||||||||
| Общий конечный объем (мл) | 3500 | |||||||||||
| Дистиллированная объем воды (мл) | 2314 | |||||||||||
Обобщенные данные первого этап и второй этап анализа роста клеток показаны в таблице 5.На первом этапе выход биомассы достиг 0,20, как и ожидалось, в среде с избытком глюкозы, где штаммов Saccharomyces cerevisiae предпочитают анаэробное дыхание. Увеличение биомассы достигло 112,8 раз, так что цель получения высокого прироста биомассы на этом первом этапе была достигнута. Напротив, на втором этапе общий выход биомассы был выше, достигая 0,33, а увеличение биомассы составляло 6,4 раза, что является приемлемым значением для промышленного производства биомассы. Однако ожидалось, что выход биомассы будет ближе к 0.5, как это происходит в промышленных биореакторах.
Модель роста клеток второй стадии показана на . Кривая экспоненциальной регрессии хорошо согласуется с экспериментальными данными. Удельная скорость роста составила 0,165 ч -1 , что подтверждает хорошие параметры роста штамма Y167 и хорошую начальную оценку 0,18 ч -1 .
показывает профиль концентрации биомассы. Расчетная концентрация биомассы относится к значениям, рассчитанным на основе электронной таблицы, а экспериментальная концентрация биомассы относится к значениям, рассчитанным на основе массы сухих клеток.Эти данные показывают, что после 6 часов реальная концентрация биомассы в реакторе была ниже ожидаемого значения, а питательные вещества и сахар могли подаваться в избытке.
Профиль концентрации биомассы.
Сахарный профиль второй стадии показан на . Концентрация ТРС поддерживалась ниже 1 г/л до 5 часов. Через 6 часов TRS увеличился примерно с 1 г/л до 3 г/л, вероятно, из-за концентрации биомассы ниже прогнозируемого значения.
Другие интересные переменные, которые должны помочь в анализе данных, представлены в . Выход биомассы рассчитывался как мгновенный и кумулятивный, т.е. , выход за интервал в один час (Y X/S Мгновенный в 5 час относится к интервалу с 4 час до 5 -й -й час) и доходность от нулевого времени до текущего времени соответственно. Совокупный выход биомассы начинается с низкого значения 0,24 и достигает максимального значения 0.45 в 6 час . После 6 -го -го часа можно заметить небольшую тенденцию к более низким значениям до общего значения 0,33. В отличие от профиля сахара, кумулятивное падение выхода биомассы тесно связано с увеличением TRS, что подтверждает сильную тенденцию дрожжей к переключению метаболизма с аэробного на анаэробное дыхание при избытке сахара в бульоне. Мгновенный выход биомассы показал разброс значений, но следовал той же тенденции, что и кумулятивные значения.
Профиль мгновенного и кумулятивного выхода биомассы.
Обсуждение
На типичном заводе по производству биомассы размножение дрожжей начинается точно так же, как анализ, представленный в этой работе: от скошенного агара до посевного реактора до 150 000-литровых биореакторов (барботажные колонные реакторы). Рост дрожжей в колбе представляет собой рост дрожжей в посевном реакторе, где стерильный рост необходим для гарантии инокулята чистой культуры. Первая и вторая стадии реактора с барботажной колонной представляют собой первую и вторую стадии размножения дрожжей в больших биореакторах.На первом этапе цель состоит в том, чтобы получить высокий прирост биомассы (продуктивности), чтобы выход биомассы на субстрате не был важной переменной и не требовалось контролировать кормление. На втором этапе цель состоит в том, чтобы максимизировать выход биомассы на субстрате путем постепенной подачи мелассы, чтобы избежать катаболитной репрессии. Эта стратегия кормления используется со второй стадии размножения до конечных биореакторов, где выход биомассы имеет большое значение для производственных затрат.Высокая плотность ячеек и большой рабочий объем, достигаемые на этих стадиях процесса, превращают потребление мелассы в значительную переменную затрат, поэтому необходимы хорошая стратегия кормления и управление процессом.
Другой важной переменной в производстве биомассы является аэрация и перенос кислорода, когда выход биомассы зависит от достижения полностью аэробных условий. Это условие нелегко смоделировать в барботажных реакторах в лабораторных масштабах из-за небольшой высоты реактора, что приводит к короткому времени пребывания пузырьков воздуха.В случае анализа, представленного в этой работе, рабочая высота биореактора была слишком мала по сравнению с промышленными биореакторами, поэтому время пребывания пузырьков воздуха было недостаточным для достижения максимального растворенного кислорода в бульоне. Значения выхода биомассы свидетельствовали о том, что условия эксперимента не достигли полностью аэробных условий. Следовательно, относительно низкое значение выхода биомассы, полученное в этой работе, объясняется ограниченной доступностью кислорода, вызванной плохим переносом кислорода и малым временем пребывания пузырьков воздуха, обеспечиваемым конструкцией и размером реактора соответственно (Fiecher, Käppeli and Meussdoerffer, 1987). ).Другим фактом, который подтверждает доказательства плохой оксигенации бульона, был интенсивный запах ацетальдегида в лаборатории во время анализа, а также наличие и постоянно растущая концентрация побочных продуктов, обнаруженных анализом ВЭЖХ (результаты не подсчитывались количественно).
Концентрация клеток в бульоне после 6 th часов была ниже расчетного значения. Это говорит о том, что, согласно теории электронных таблиц, количество TRS, подаваемое с этого момента до конца эксперимента, было избыточным.Это может объяснить увеличение TRS в бульоне () и снижение значений выхода биомассы () вместе с плохой оксигенацией. В условиях более высокой плотности клеток можно теоретически рассчитать поглощение кислорода и добавить его в электронную таблицу, чтобы аэрация увеличивалась по мере увеличения биомассы. Узкое место оксигенации в небольших операциях затрудняет моделирование предыдущих стадий. Это было смоделировано на стадии 3 rd (результаты здесь не показаны), но результаты ясно показали, что перенос кислорода недостаточен даже при скорости аэрации выше 45 л/мин.Кроме того, было замечено, что клетки серьезно повреждены, а жизнеспособность клеток падает до 50%. Это было связано с сильным напряжением сдвига, вызванным высокой скоростью потока пузырьков воздуха.
Выводы
Производство биомассы промышленных дрожжей представляет собой хорошо отработанный и простой процесс, который с течением времени совершенствовался благодаря внедрению более совершенных концепций, дизайна и стратегий управления процессом. Настоящая работа была сосредоточена на улучшении управления технологическим процессом с помощью простой стратегии кормления с ограничением содержания глюкозы.Показанные здесь результаты хорошо согласуются с промышленной реальностью, и симулятор электронных таблиц может быть полезным инструментом в управлении и контроле процесса производства биомассы.
Благодарности
CAPES, Бразильский комитет по улучшению кадров высшего образования, за стипендию, присужденную первому автору.
Каталожные номера
- Айба С. Увеличение масштаба. В: Хамфри А.Э., Миллис Н.Ф., редакторы. Биохимическая инженерия. Издательство Токийского университета; Токио: 1971.[Google Scholar]
- Акиниеми ОП, Бетику Э, Соломон БО. Направление субстрата и энергетика Saccharomyces cerevisiae DSM 2155, выращенных на глюкозе в процессе периодической ферментации с подпиткой. Afr J Биотехнология. 2005; 2:96–103. [Google Scholar]
- Аткинсон Б., Мавитуна Ф. Справочник по биохимической инженерии и биотехнологии. Стоктон Пресс; 1991. с. 120. [Google Scholar]
- Bauer J, Luttik MAH, Flores CL, van Dijken JP, Pronk JT, Niederberger P. Образование побочных продуктов при воздействии избытка глюкозы на дышащие культуры Saccharomyces cerevisiae не вызвано ограниченной способностью пирувата карбоксилаза.FEMS Microbiol Lett. 1999; 179:107–113. [PubMed] [Google Scholar]
- Beudeker RF, van Dam HW, van der Plaat JB, Vellenga K. Развитие производства пекарских дрожжей. В: Verachtert H, DeMot R, редакторы. Дрожжевая биотехнология и биокатализ. Марсель Деккер; Нью-Йорк: 1990. С. 103–146. [Google Scholar]
- Дрожжи Burrows S. Backer’s. В: Роуз А.Х., редактор. Микробная биомасса. Том. 4. Академическая пресса; Нью-Йорк: 1979. С. 30–63. [Google Scholar]
- Ди Серио М., Де Альтериис Э., Параскандола П., Сантачесария Э.Общая кинетическая и массообменная модель для имитации роста пекарских дрожжей в биореакторах. Катал сегодня. 2001; 66: 437–445. [Google Scholar]
- Di Serio M, Tesser R, Santacesaria E. Кинетическая и массообменная модель для имитации роста пекарских дрожжей в промышленных биореакторах. Chem Eng J. 2001; 82: 347–354. [Google Scholar]
- Dynesen J, Smits HP, Olsson L, Nielsen J. Углеродная катаболитная репрессия инвертазы во время периодического культивирования Saccharomyces cerevisiae: роль глюкозы, фруктозы и маннозы.Приложение Microbiol Biotechnol. 1998; 50: 579–582. [PubMed] [Google Scholar]
- EPA . Производство дрожжей. [Проверено 20 июня 2011 г.]; Сборник коэффициентов выбросов загрязняющих веществ в атмосферу: AP-42. (Пятое издание). 1995 г., том I (глава 9.13.4). Доступно по адресу: http://www.epa.gov/ttn/chief/ap42. [Google Scholar]
- Фихер А., Каппели О., Меусдорффер Ф. Ванна и непрерывная культура. В: Роуз А.Х., Харрисон Дж.С., редакторы. Дрожжи. 2-е издание. Том. 2. Академическая пресса; Нью-Йорк: 1987. С. 99–129. [Google Scholar]
- Фрик О, Витманн С.Характеристика метаболического сдвига между окислительным и ферментативным ростом Saccharomyces cerevisiae с помощью сравнительного анализа потоков 13 C. Фабрики микробных клеток. 2005; 4:30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Халаш А., Ластити Р. Использование дрожжевой биомассы в производстве продуктов питания. КПР Пресс; Бока-Ратон, Флорида: 1991. с. 312. [Google Scholar]
- Hensing MCM, Rouwenhorst RJ, Heijnen JJ, van Dijken JP, Pronk JT. Физиологические и технологические аспекты крупномасштабного производства гетерологичных белков с помощью дрожжей.Антон ван Ли. 1995; 67: 261–279. [PubMed] [Google Scholar]
- van Dijken JP, Weusthuis RA, Pronk JT. Кинетика роста и потребления сахара дрожжами. Антон ван Ли. 1993; 63: 343–352. [PubMed] [Google Scholar]
- Джонс К.Д., Компала Д.С. Кибернетическая модель динамики роста Saccharomyces cerevisiae в периодических и непрерывных культурах. Дж Биотехнолог. 1999; 71: 105–131. [PubMed] [Google Scholar]
- Kantarcia N, Borakb F, Ulgen KO. Реакторы барботажной колонны. Процесс биохим.2005;40:2263–2283. [Google Scholar]
- Каппели О. Регуляция углеродного обмена у Saccharomyces cerevisiae и родственных им дрожжей. Ад Микроб Физиол. 1986; 28: 181–209. [PubMed] [Google Scholar]
- Lange HC, Heijnen JJ. Статистическая сверка элементного и молекулярного состава биомассы Saccharomyces cerevisiae. Биотехнология Биоинж. 2001; 75: 334–344. [PubMed] [Google Scholar]
- Rendez-Gil F, Sanz P, Prieto JA. Технические пекарские дрожжи: возможности для совершенствования.Тенденции биотехнологии. 1999; 17: 237–244. [PubMed] [Google Scholar]
- Рейман Г. Моделирование и контроль периодической ферментации пекарских дрожжей. Пищевой контроль. 1992; 3:33–44. [Google Scholar]
- Рингбом К., Ротберг А., Саксен Б. Автоматизация производства пекарских дрожжей на основе моделей. Дж Биотехнолог. 1996; 51: 73–82. [PubMed] [Google Scholar]
- Роуз А.Х. История и научные основы крупномасштабного производства микробной биомассы. В: Роуз А.Х., редактор. Микробная биомасса. Том. 4. Академическая пресса; Нью-Йорк: 1979.стр. 1–29. [Google Scholar]
- Роуз А.Х. Реакция на химическую среду. В: Роуз А.Х., Харрисон Дж.С., редакторы. Дрожжи. 2-е издание. Том. 2. Академическая пресса; Нью-Йорк: 1987. С. 5–40. [Google Scholar]
- Soley A, Lecina M, Gámez X, Cairó JJ, Riu P, Rosell X, Bragós R, Gòdia F. Он-лайн мониторинг роста дрожжевых клеток с помощью импедансной спектроскопии. Дж Биотехнолог. 2005; 118: 398–405. [PubMed] [Google Scholar]
- Sonnleitner B, Käppeli O. Рост Saccharomyces cerevisiae контролируется его ограниченной дыхательной способностью: формулировка и проверка гипотезы.Биотехнология Биоинж. 1986; 28: 927–937. [PubMed] [Google Scholar]
- Ван Хук П., Ван Дейкен Дж., Пронк Дж. Влияние удельной скорости роста на ферментативную способность пекарских дрожжей. Appl Environ Microbiol. 1998;64:4226–4233. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Verduyn C. Физиология дрожжей в зависимости от выхода биомассы. Антон ван Ли. 1991; 60: 325–53. [PubMed] [Google Scholar]
дрожжи | Определение и использование
дрожжи , любой из примерно 1500 видов одноклеточных грибов, большинство из которых относится к типу Ascomycota, и лишь некоторые из них относятся к типу Basidiomycota.Дрожжи встречаются во всем мире в почве и на поверхности растений, особенно в сахаристых средах, таких как цветочный нектар и фрукты. Существуют сотни экономически важных разновидностей аскомицетов; типы, обычно используемые в производстве хлеба, пива и вина, представляют собой отобранные штаммы Saccharomyces cerevisiae . Некоторые дрожжевые грибки являются патогенами человека и других животных от легких до опасных, особенно Candida albicans , Histoplasma и Blastomyces .
Физическое описание
Как и грибы, дрожжи являются эукариотическими организмами. Обычно они имеют диаметр около 0,075 мм (0,003 дюйма) и имеют множество форм: от сферической до яйцевидной и нитевидной. Большинство дрожжей размножаются бесполым путем путем почкования: небольшой бугорок выступает из родительской клетки, увеличивается, созревает и отделяется. Некоторые дрожжи размножаются делением, при этом родительская клетка делится на две равные клетки. Torula — род диких несовершенных дрожжей, никогда не образующих половых спор.
дрожжиПочкующиеся дрожжевые клетки.
Science Photo Library/age fotostockПодробнее по этой теме
дистиллированный спирт: дрожжи и дрожжевая культура
Как упоминалось выше, дрожжей встречаются по всему миру; более 8000 штаммов этого вегетативного микроорганизма…
Применение
В производстве пищевых продуктов дрожжи используются для ферментации и разрыхления.Грибы питаются сахарами, производя спирт (этанол) и углекислый газ; в производстве пива и вина желаемым продуктом является первое, а в выпечке — второе. В игристых винах и пиве часть углекислого газа остается в готовом напитке. Спирт, образующийся при выпечке хлеба, удаляется при выпечке теста. Ферментация вина и хлеба на закваске часто инициируется естественными дрожжами, присутствующими в воздухе. Одна дрожжевая клетка может ферментировать глюкозу примерно на свой вес в час.
В промышленном производстве отдельные штаммы дрожжей подкармливают раствором мелассы, минеральных солей и аммиака. Когда рост прекращается, дрожжи отделяют от питательного раствора, промывают и упаковывают. Дрожжи для выпечки продаются в прессованных лепешках, содержащих крахмал, или в сухом гранулированном виде, смешанном с кукурузной мукой.
Коммерческие дрожжи на 50 процентов состоят из белка и являются богатым источником витаминов B 1 , B 2 , ниацина и фолиевой кислоты. Пивные дрожжи и пищевые дрожжи, которые дезактивированы (неживые), можно употреблять в пищу в качестве витаминной добавки.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Мелиссой Петруцелло.Три удивительные вещи, о которых вы могли не знать : NewsCenter
18 февраля 2021 г.
Понимание биологии S. cerevisiae, или пекарских дрожжей, может помочь вашей домашней выпечке подняться на новый уровень. (Гетти изображения)Биолог из Рочестера Джастин Фэй изучает
Saccharomyces cerevisiae , также известных как пекарские или пивные дрожжи.Заказы на дом в связи с COVID-19 способствовали развитию тенденции домашней выпечки, когда производители хлеба-любители, такие как мастера-пекари и пивовары, начинают экспериментировать с различными штаммами пекарских дрожжей и заквасками.
Штаммы дрожжей, используемые для приготовления пива, хлеба и вина, происходят из вида дрожжей, называемого Saccharomyces cerevisiae . S. cerevisiae известен как «пивные дрожжи» или «пекарские дрожжи» по уважительной причине: он отвечает за ферментацию, которая делает пиво алкогольным и позволяет комку теста подняться в буханку хлеба.В присутствии кислорода S. cerevisiae превращает сахара из углеводов, таких как мука, используемая для выпечки хлеба, или ячмень, используемый для производства пива, в углекислый газ. Углекислый газ надувает пузырьки воздуха внутри теста, заставляя тесто подниматься.
Джастин Фэй, профессор биологии Рочестерского университета, изучает сложное происхождение S. cerevisiae , чтобы ответить на важные вопросы эволюционной биологии, в том числе на то, как дифференцируются виды.
« S. cerevisiae — фантастический модельный организм, — говорит Фэй. «Это был первый эукариот, чей геном был секвенирован. Это, в сочетании с потрясающей силой генетики дрожжей, делает его одним из самых привлекательных организмов для понимания генетической основы эволюционных изменений».
Но понимание S. cerevisiae также может помочь вашей домашней выпечке подняться на новый уровень.
Колонии дрожжевых клеток растут на чашке с агаром в лаборатории биолога из Рочестера Джастина Фэя.
Профессор биологии Рочестерского университета Джастин Фэй в своей лаборатории в Хатчисон-холле, где он изучает дрожжи, чтобы решить более важные вопросы эволюционной биологии. (Фотографии Рочестерского университета / Дж. Адам Фенстер)
Пекарские дрожжи, одомашненные из диких штаммов, получают из комбинации штаммов дрожжей, используемых для производства европейского виноградного вина, и штаммов, используемых для производства азиатского рисового вина.
Подобно тому, как волки стали домашними собаками, а пшеница стала одомашненной культурой с распространением сельского хозяйства, пекарские дрожжи были одомашнены от своих диких предков.
Связанная с человеком миграция и смешение с дикими популяциями дрожжей оказали сильное влияние на S. cerevisiae , но его историческое происхождение было трудно определить, поскольку дрожжи существовали задолго до того, как люди открыли и изучили микроорганизмы. Фэй и его коллеги обнаружили, что геном S. cerevisiae получен из комбинации штаммов дрожжей, используемых для производства европейского виноградного вина, и дрожжей, используемых для производства азиатского рисового вина. Они предполагают, что современные пекарские дрожжи получены из плавильного котла технологии брожения в результате переноса с Востока на Запад, аналогичного распространению одомашненных растений и животных по Шелковому пути тысячи лет назад.
Что такое дрожжи?Дрожжи — это одноклеточные живые микроорганизмы, принадлежащие к царству грибов. Saccharomyces cerevisiae , также известные как пивные или пекарские дрожжи, на протяжении тысячелетий были ключевым ингредиентом в выпечке, виноделии и пивоварении. Он получил свое название от латинизированного греческого слова, означающего «сахарный гриб», потому что в процессе ферментации он превращает сахара и крахмалы в спирт и углекислый газ.
Пекарские дрожжи были одомашнены таким образом, чтобы облегчить процесс брожения (и улучшить вкус).
«Большинство организмов не сбраживают сахар в спирт, но дрожжи делают это», — говорит Фэй. «Способность дрожжей делать это делает их невероятно полезными, а также вызывает вопросы о том, как дрожжи развили эту способность».
Хотя штаммы диких дрожжей также могут сбраживать сахар, они обладают многими нежелательными характеристиками, которые часто делают их непопулярным выбором для приготовления пива, вина и хлеба. Штаммы диких дрожжей генетически отличаются от одомашненных пекарских дрожжей. Одно из отличий заключается в том, как их клетки слипаются и делятся, определяя, насколько быстро происходит процесс брожения и будут ли дрожжи подниматься на поверхность или опускаться на дно во время брожения.Дикие дрожжи часто приводят к непредсказуемому брожению, что может привести к появлению неприятных вкусов и ароматов.
Люди оказали селекционное давление на одомашненные пекарские и пивные дрожжи, чтобы позволить им быстрее начать процесс брожения, более эффективно выдерживать условия обработки, такие как замораживание и сушка, а также более эффективно расщеплять и метаболизировать сложную сахарную мальтозу. Мальтоза является основным сахаром, присутствующим в пивном сусле, также известном как «пивная закваска» перед ферментацией пива, и в хлебобулочных изделиях.
«Винные штаммы устойчивы к сульфитам, что помогает избежать порчи», — говорит Фэй. «Пивные и пекарские штаммы имеют повышенный метаболизм мальтозы».
Не все штаммы
S. cerevisiae одинаковы; различные штаммы используются для приготовления различных вкусов пива, хлеба и вина.Поскольку S. cerevisiae был одомашнен, он сам эволюционировал в различные штаммы. Пекарские дрожжи, обычно используемые в хлебном тесте, получают из нескольких одомашненных штаммов S.cerevisiae , производимые дрожжевыми компаниями, такими как Fleischmann’s, Red Star и SAF. Однако «закваска», используемая для приготовления хлеба на закваске, может быть более разнообразной и обычно представляет собой смесь коммерческих, одомашненных штаммов S. cerevisiae и диких штаммов.
Исследование 2020 года, опубликованное в журнале Frontiers in Genetics , показало, что закваски и коммерческие штаммы дрожжей для выпечки производят значительно больше углекислого газа, чем дикие штаммы, и достигают брожения быстрее, что влияет на аромат и вкус.
Окружающая среда дрожжей также может сильно повлиять на их генетическое разнообразие и привести к более желательным признакам. Пивные дрожжи часто хранятся в помещении в условиях пивоварения, что ограничивает их контакт с дикими дрожжами. Их повторно собирают после процесса ферментации, что приводит к непрерывному генетическому отбору в соответствии с условиями пивоварения в помещении. Различные штаммы пивных дрожжей могут определять вкус, например, лагера по сравнению с элем. Винные дрожжи, с другой стороны, проводят большую часть времени снаружи на виноградниках и вокруг них, что приводит к большей гибридизации с дикими дрожжами.
Подробнее Пивные дрожжи: разгадка истории происхождения с помощью генетики
Saccharomyces cerevisiae, или пивные дрожжи, использовались для приготовления пива на протяжении тысячелетий. Чтобы реконструировать историю современных штаммов эля, биолог из Рочестера Джастин Фэй и его коллеги секвенировали геном современных пивных дрожжей. Q&A: Биолог получает восторженные отзывы за работу с дрожжами
Дэвид Гольдфарб, профессор биологии, исследует дрожжи как модельный организм для понимания процесса старения у людей.Почему этот важный ингредиент в хлебе и пиве является хорошим образцом для исследований?
Теги: Искусства и науки, Факультет биологии, Джастин Фэй
Категория : Наука и технологии
. 01.2022
01.2022
Комментариев нет